Extração e Purificação da Proteína FAHD1 do fígado de rim suíno e rato
Summary
Este protocolo descreve como extrair a proteína de domínio de hidrolase 1 (FAHD1) de rim suíno e fígado de camundongo. Os métodos listados podem ser adaptados a outras proteínas de interesse e modificados para outros tecidos.
Abstract
Fumarylacetoacetate hydrolase proteína contendo domínio 1 (FAHD1) é o primeiro membro identificado da superfamília FAH em eucariotes, agindo como oxaloacetate decarboxylase em mitocôndrias. Este artigo apresenta uma série de métodos para a extração e purificação do FAHD1 a partir de fígado de rim suíno e rato. Os métodos cobertos são cromatografia de troca iônica com cromatografia líquida de proteína rápida (FPLC), filtragem de gel preparatório e analítico com FPLC e abordagens proteômicas. Após a extração total da proteína, a precipitação de sulfato de amônio e a cromatografia de troca iônica foram exploradas, e o FAHD1 foi extraído através de uma estratégia sequencial usando troca iônica e cromatografia de exclusão de tamanho. Esta abordagem representativa pode ser adaptada a outras proteínas de interesse (expressas em níveis significativos) e modificada para outros tecidos. A proteína purificada do tecido pode apoiar o desenvolvimento de anticorpos de alta qualidade e/ou potentes e específicos inibidores farmacológicos.
Introduction
A proteína de domínio fah eucariótico 1 (FAHD1) atua como oxaloacetato bifuncional (OAA) decarboxylase (ODx)1 e hidrolase acylpyruvate (ApH)2. Está localizada nas mitocôndrias2 e pertence à ampla superfamília FAH de enzimas 1,2,3,4,5,6. Embora sua atividade de ApH seja apenas de menor relevância, a atividade ODx do FAHD1 está envolvida na regulação do fluxo de ciclo TCA 1,7,8,9. OAA não é apenas necessário para a reação de sinthase citrato central no ciclo do ácido tricarboxílico, mas também age como um inibidor competitivo de succinato desidrogenase como parte do sistema de transporte de elétrons e como metabólito catapleótico. A redução da expressão genética FAHD1 nas células endoteliais da veia umbilical humana (HUVEC) resultou em uma redução significativa na taxa de proliferação celular10, e inibição significativa do potencial da membrana mitocondrial, associada a uma mudança concomitante para a glicólise. O modelo de trabalho refere-se à senescência associada à disfunção mitocondrial (MiDAS)11-like fenótipo8, onde os níveis mitocondrial de OAA são fortemente regulados pela atividade FAHD1 1,8,9.
A proteína recombinante é mais fácil de obter através da expressão e purificação de bactérias12 em vez de tecido. No entanto, uma proteína expressa em bactérias pode ser tendenciosa por possível falta de modificações pós-translacionais, ou pode ser simplesmente problemática (ou seja, devido à perda de plasmídeos, respostas de estresse bacteriano, ligações de dissulfeto distorcidas/não formadas, nenhuma ou má secreção, agregação de proteínas, decote protelítico, etc.). Para determinadas aplicações, a proteína precisa ser obtida a partir de lisesto celular ou tecido, a fim de incluir tais modificações e/ou excluir possíveis artefatos. A proteína purificada do tecido suporta o desenvolvimento de anticorpos de alta qualidade e/ou inibidores farmacológicos potentes e específicos para enzimas selecionadas, como para FAHD113.
Este manuscrito apresenta uma série de métodos para a extração e purificação do FAHD1 a partir de fígado de rim suíno e rato. Os métodos descritos requerem cromatografia líquida de proteína rápida (FPLC), mas de outra forma usam equipamentos de laboratório comuns. Métodos alternativos podem ser encontrados em outros lugares 14,15,16,17. Após a extração total da proteína, o protocolo proposto envolve uma fase de teste, na qual são discutidos sub-protocolos para precipitação de sulfato de amônio e cromatografia de troca iônica (Figura 1). Após a definição desses subtítnicos, a proteína de interesse é extraída através de uma estratégia sequencial usando troca iônica e cromatografia de exclusão de tamanho com FPLC. Com base nessas diretrizes, o protocolo final pode ser adaptado individualmente para outras proteínas de interesse.
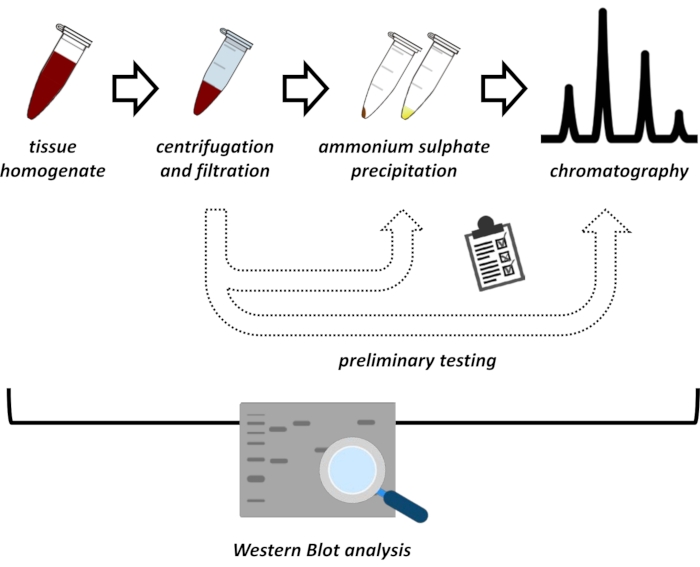
Figura 1: A estratégia global deste protocolo. De cima para baixo: A proteína é extraída de tecidos. A homogeneidade do tecido é preparada, centrifugada e filtrada. Para cada par de amostras supernascidas e derivadas de pelotas, os testes para precipitação de sulfato de amônio e cromatografia de troca iônica (FPLC) precisam ser realizados para sondar para condições ideais. Após a criação desses sub-protocolos, a proteína pode ser extraída através de um procedimento sequencial de precipitação de sulfato de amônio, cromatografia de troca iônica e cromatografia de exclusão de tamanho repetitivo (FPLC) em diferentes concentrações de pH e sal. Todos os passos precisam ser controlados por mancha ocidental. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Passos críticos no protocolo
Seguir diretrizes comuns para o manuseio de proteínas é essencial, como trabalhar no gelo e em condições moderadas de pH e sal. O uso de inibidores de protease é benéfico para o método, enquanto o uso de inibidores proteasso é altamente recomendado. Congelar e descongelar a amostra pode sempre resultar em precipitação proteica (pelo menos parcialmente), por isso qualquer alíquota descongelada de lisato de proteína inicial (etapa 2) deve ser processada continua…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Os autores agradecem muito a assistência técnica de Ayse Öztürk e Eva Albertini. Os camundongos utilizados para a geração de tecido hepático foram mantidos sob a supervisão da Univ.-Doz. Dr. Pidder Jansen-Dürr (Instituto de Pesquisa de Envelhecimento Biomédico da Universidade de Innsbruck, Rennweg 10, 6020 Innsbruck, Áustria).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

