Outils pour le traitement de surface des microélectrodes intracorticales planes au silicium
Summary
Le présent protocole décrit les outils de manipulation des microélectrodes intracorticales planaires de silicium lors de traitements de modification de surface par dépôt de gaz et réactions de solution aqueuse. L’assemblage des composants utilisés pour manipuler les appareils tout au long de la procédure est expliqué en détail.
Abstract
Les microélectrodes intracorticales ont un grand potentiel thérapeutique. Mais ils sont confrontés à une réduction significative des performances après des durées d’implantation modestes. Un contributeur substantiel au déclin observé est l’endommagement du tissu neural proximal à l’implant et la réponse neuro-inflammatoire subséquente. Les efforts visant à améliorer la longévité de l’appareil comprennent des modifications chimiques ou des applications de revêtement à la surface de l’appareil pour améliorer la réponse des tissus. Le développement de tels traitements de surface est généralement effectué à l’aide de sondes « factices » non fonctionnelles dépourvues des composants électriques requis pour l’application prévue. La traduction en dispositifs fonctionnels nécessite une attention supplémentaire compte tenu de la fragilité des réseaux de microélectrodes intracorticales. Les outils de manutention facilitent grandement les traitements de surface des appareils assemblés, en particulier pour les modifications qui nécessitent de longs délais de procédure. Les outils de manutention décrits ici sont utilisés pour les traitements de surface appliqués par dépôt en phase gazeuse et exposition à une solution aqueuse. La caractérisation du revêtement est réalisée par ellipsométrie et spectroscopie photoélectronique à rayons X. Une comparaison des enregistrements de spectroscopie d’impédance électrique avant et après la procédure de revêtement sur les dispositifs fonctionnels a confirmé l’intégrité de l’appareil après modification. Les outils décrits peuvent être facilement adaptés aux dispositifs d’électrodes alternatifs et aux méthodes de traitement qui maintiennent la compatibilité chimique.
Introduction
Les dispositifs neuroprothétiques visent à restaurer les capacités sensorielles et motrices altérées ou absentes dans un large éventail de populations de patients, y compris ceux souffrant de lésions de la moelle épinière, de sclérose latérale amyotrophique (SLA), de paralysie cérébrale et d’amputations 1,2,3. Les microélectrodes intracorticales (EMI) peuvent établir une voie de communication entre les neurones corticaux et les dispositifs utilisés pour contrôler les neuroprothèses. Un avantage distinct des microélectrodes intracorticales est leur capacité à enregistrer des signaux neuronaux à la haute résolution spatiale et temporelle, ce qui est préférable pour le traitement ultérieur du signal et le contrôle des interfaces cerveau-ordinateur 4,5. Malheureusement, la performance des microélectrodes intracorticales diminue considérablement dans les mois à un an suivant l’implantation 2,6,7,8. La perte de qualité et de stabilité du signal affecte négativement l’application de la technologie.
Un contributeur significatif à la baisse de performance observée est la réponse biotique aux lésions tissulaires associées à l’implantation et à la neuroinflammation chronique 9,10,11. L’implantation d’IME inflige des dommages aux tissus cérébraux, entraînant la libération de molécules de signalisation qui initient des cascades de processus de défense cellulaire réactionnaires. L’interfaçage chronique exacerbe la réponse des corps étrangers, entraînant une neuroinflammation soutenue qui endommage les tissus proximaux de l’appareil; souvent reconnus comme des symptômes de neuroinflammation, de cicatrisation et de neurodégénérescence locale contribuant au déclin de l’enregistrement de la qualité du signal 12,13,14,15. Composée d’un conglomérat dense d’astrocytes avec des microglies et des macrophages activés entraînés, la cicatrice qui encapsule l’électrode crée un environnement local défavorable avec un transport de matériau réduit et une accumulation locale de facteurs inflammatoires 16,15,16,17,18.
De nombreuses études ont décrit la réponse du cerveau aux microélectrodes intracorticales ou des approches pour atténuer la réponse7. La recherche et le développement visant à améliorer la réponse tissulaire ont impliqué une gamme de stratégies, y compris des modifications de la structure globale, de la topologie de surface, des matériaux et de l’application des revêtements. Ces efforts visent à minimiser les dommages subis par l’événement d’implantation, à introduire une interface plus favorable entre le dispositif et les cellules proximales, ou à réduire la tension tissulaire après l’implantation du dispositif7. Les méthodes ciblant spécifiquement la réponse biologique chronique ont conduit à plusieurs revêtements bioactifs qui visent à stabiliser le site d’implantation et à promouvoir chimiquement la santé cellulaire. Les exemples incluent les polymères conducteurs tels que le poly(éthylène dioxythiophène) (PEDOT)19,20, les nanotubes de carbone21, les hydrogels22 et l’ajout de molécules bioactives et de médicaments pour cibler des processus cellulaires spécifiques 23,24,25. Notre groupe de recherche, en particulier, a exploré de nombreux mécanismes pour favoriser une réduction de la réponse inflammatoire aux microélectrodes implantées, y compris, mais sans s’y limiter, minimiser le traumatisme associé à l’implantation du dispositif26, minimiser l’inadéquation de rigidité du dispositif / tissu 27,28,29,30,31,32,33, optimiser la stérilisation procédures34,35, réduction du stress oxydatif / dommages 28,36,37,38,39,40,41,42, exploration de matériaux d’électrode alternatifs43 et imitation de la nano-architecture de la matrice extracellulaire naturelle 44,45,46 . L’intérêt récent est le développement de revêtements de surface biomimétiques pour atténuer la réponse neuro-inflammatoire à l’interface tissulaire de la microélectrode directement39.
La modification de l’interface offre l’avantage unique de cibler directement la plaie et le tissu proximal nécessaires à l’enregistrement du signal. Un traitement de surface qui favorise la guérison sans exacerber la réponse immunitaire peut bénéficier de la durée de vie de l’enregistrement de la qualité et éliminer les limites dans la réalisation du potentiel thérapeutique et de recherche des microélectrodes intracorticales. Le travail présenté détaille les méthodes d’application de traitements de surface aux réseaux de microélectrodes qui nécessitent des temps de réaction prolongés tout en tenant compte de la fragilité des dispositifs. La technique présentée vise à partager les méthodes de modification de surface avec les dispositifs fonctionnels où le dispositif ne peut pas être manipulé tout au long de l’application de traitement. Les outils sont présentés pour la manipulation de sondes factices non fonctionnelles et de réseaux de microélectrodes planes en silicium fonctionnel.
L’approche présentée pour modifier la surface de l’électrode permet la suspension sécurisée de sondes factices non fonctionnelles ou de réseaux d’électrodes planes en silicium fonctionnel pour le dépôt en phase gazeuse et la réaction avec des solutions aqueuses. Plusieurs pièces imprimées en 3D sont utilisées pour manipuler ces dispositifs fragiles (Figure 1 et Figure 2). Un exemple est fourni d’une procédure qui utilise à la fois des étapes de phase gazeuse et de phase de solution pour la modification de surface avec un revêtement antioxydant impliquant l’immobilisation de la porphyrine Mn(III)tétrakis (acide 4-benzoïque) (MnTBAP). MnTBAP est une métalloporphyrine synthétique possédant des propriétés antioxydantes avec une médiation démontrée de l’inflammation47,48. L’exemple fourni sur les réseaux d’électrodes planes en silicium fonctionnel valide une mise à jour d’un protocole précédemment signalé pour les dispositifs non fonctionnels40. L’adaptation d’une technique de dépôt en phase gazeuse de Munief et al. soutient la compatibilité du protocole avec les électrodes fonctionnelles49. Le dépôt en phase gazeuse est utilisé pour fonctionnaliser la surface par amine en préparation de la réaction aqueuse impliquant la chimie du réticulant carbodiimide afin d’immobiliser le MnTBAP actif. La méthodologie de manipulation développée ici est fournie sous la forme d’une plate-forme qui peut être modifiée pour accueillir d’autres revêtements et dispositifs similaires.
Le protocole illustre l’approche utilisant des sondes factices non fonctionnelles comprenant une tige en silicium et une languette imprimée en 3D avec des dimensions similaires aux réseaux d’électrodes planes en silicium fonctionnel. L’emballage du connecteur de l’appareil est considéré comme analogue à la languette imprimée en 3D de la sonde factice non fonctionnelle dans l’instruction fournie.
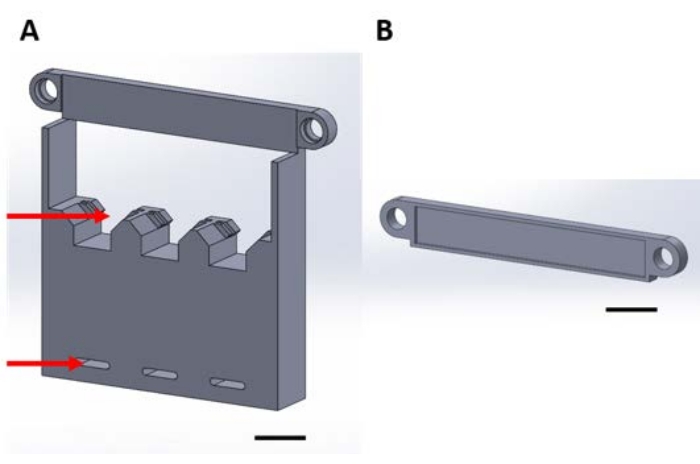
Figure 1 : Pièces imprimées en 3D pour la manipulation de dispositifs fonctionnels lors du dépôt en phase gazeuse dans un dessiccateur sous vide. (A) La base de la structure comprend des supports pour des carrés de silicium d’échantillon de 1 cm x 1 cm (flèche supérieure) et des trous pour la fixation à la plaque du dessiccateur (flèche inférieure). (B) La plaque est utilisée pour fixer la suspension des dispositifs. À partir de là, chaque pièce de cette figure sera appelée pièce 1A ou 1B. Barre d’échelle = 1 cm. Veuillez cliquer ici pour agrandir cette figure.
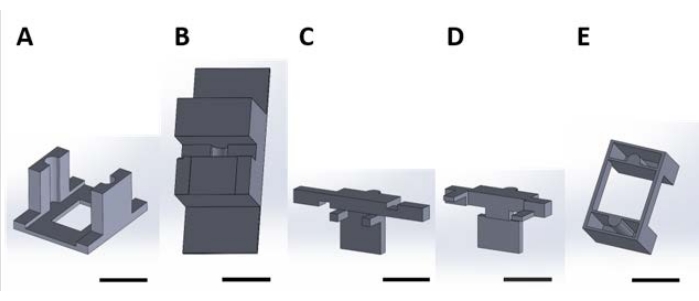
Figure 2: Pièces imprimées en 3D pour la manipulation de dispositifs fonctionnels pour la réaction de surface se produisant dans la solution aqueuse. (A) Pièce guide à coller sur le couvercle de la plaque de culture. (B) Pièces de paillasse utilisées pour stabiliser les pièces (C) et (D) lors de l’assemblage. (C) et (D) fixent ensemble la suspension des dispositifs à placer dans la plaque du puits, et (E) fixent en outre les pièces (C) et (D) au couvercle de la plaque du puits. À partir de là, les pièces individuelles de chaque panneau de cette figure seront appelées numéros de pièce correspondant au numéro de panneau de cette figure. Barre d’échelle = 1 cm. Veuillez cliquer ici pour agrandir cette figure.
Protocol
Representative Results
Discussion
Le protocole décrit a été conçu pour le traitement de surface des réseaux de microélectrodes planes de silicium. Les outils imprimés en 3D sont personnalisés pour des réseaux de microélectrodes de style Michigan avec des connecteurs à profil bas50. Les sondes non fonctionnelles ont été assemblées en adhérant une sonde en silicium à des languettes imprimées en 3D à l’aide d’un adhésif biocompatible. Les languettes imprimées en 3D ont été conçues avec des dimensions simila…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Cette étude a été soutenue en partie par le Merit Review Award IRX002611 (Capadona) et le Research Career Scientist Award IK6RX003077 (Capadona) du Département des Anciens Combattants des États-Unis (US) Rehabilitation Research and Development Service. En outre, ce travail a également été soutenu en partie par le National Institute of Health, le National Institute of Neurological Disorders and Stroke R01NS110823 (Capadona / Pancrazio) et le National Science Foundation Graduate Research Fellowship Program (Krebs).
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

