실리콘 평면 피질 내 미세 전극의 표면 처리를위한 도구
Summary
본 프로토콜은 가스 증착 및 수용액 반응을 통한 표면 개질을 위한 처리 동안 실리콘 평면 피질 내 미세전극을 취급하기 위한 도구를 기술한다. 절차 전반에 걸쳐 장치를 처리하는 데 사용되는 구성 요소의 어셈블리가 자세히 설명되어 있습니다.
Abstract
피질 내 미세전극은 큰 치료 잠재력을 가지고 있습니다. 그러나 그들은 겸손한 이식 기간 후에 상당한 성능 감소로 어려움을 겪고 있습니다. 관찰된 감소에 실질적인 기여자는 임플란트에 근접한 신경 조직에 대한 손상 및 후속적인 신경염증 반응이다. 장치 수명을 개선하기 위한 노력은 조직 반응을 개선하기 위해 장치 표면에 화학적 변형 또는 코팅 적용을 포함한다. 이러한 표면 처리의 개발은 전형적으로 의도된 응용에 필요한 전기 부품이 결여된 비기능적 “더미” 프로브를 사용하여 완료된다. 기능 장치로의 변환은 피질 내 미세 전극 어레이의 취약성을 고려할 때 추가적인 고려가 필요합니다. 핸들링 툴은 조립된 장치, 특히 긴 절차 시간이 필요한 수정의 경우 표면 처리를 크게 용이하게 합니다. 여기에 설명 된 취급 도구는 기상 증착 및 수용액 노출을 통해 적용되는 표면 처리에 사용됩니다. 코팅의 특성화는 타원법 및 x선 광전자 분광법을 사용하여 수행된다. 기능 장치에 대한 코팅 절차 전후의 전기 임피던스 분광법 기록을 비교한 결과, 수정 후 장치 무결성이 확인되었습니다. 설명된 툴은 화학적 호환성을 유지하는 대안적인 전극 장치 및 처리 방법에 쉽게 적응될 수 있다.
Introduction
신경 보철 장치는 척수 손상, 근위축성 측삭 경화증 (ALS), 뇌 성 마비 및 절단 1,2,3을 포함한 광범위한 환자 집단에서 손상되거나 부재 한 감각 및 운동 능력을 회복시키는 것을 목표로합니다. 피질 내 미세 전극 (IMEs)은 피질 뉴런과 신경 보철물을 제어하는 데 사용되는 장치 사이의 통신 경로를 설정할 수 있습니다. 피질내 미세전극의 뚜렷한 장점은 높은 공간 및 시간적 분해능으로 신경 신호를 기록할 수 있는 능력이며, 이는 뇌-컴퓨터 인터페이스(4,5)의 후속 신호 처리 및 제어에 바람직하다. 불행히도, 피질 내 미세 전극의 성능은 이식후 몇 달에서 1 년 이내에 극적으로 감소합니다 2,6,7,8. 신호 품질 및 안정성의 손실은 기술 적용에 부정적인 영향을 미칩니다.
관찰된 성능 저하에 대한 유의한 기여자는 이식-관련 조직 손상 및 만성 신경염증9,10,11에 대한 생물학적 반응이다. IME의 이식은 뇌 조직에 손상을 입히고, 반동적 세포 방어 과정의 캐스케이드를 시작하는 신호 전달 분자의 방출을 초래합니다. 만성 인터페이싱은 이물질 반응을 악화시켜 장치에 근접한 조직을 손상시키는 지속적인 신경 염증을 유발합니다. 종종 신경 염증, 흉터 및 국소 신경 변성의 증상으로 인식되어 신호 품질12,13,14,15의 기록의 감소에 기여합니다. 동반 된 활성화 된 미세 아교세포 및 대식세포를 가진 성상 세포의 조밀 한 대기업을 포함하며, 전극을 캡슐화하는 흉터는 물질 수송 감소 및 염증 인자 16,15,16,17,18의 국소 축적으로 불리한 국소 환경을 만듭니다.
많은 연구들이 피질내 미세전극에 대한 뇌의 반응 또는 반응을 완화시키기 위한 접근법7을 기술하였다. 조직 반응을 개선하기위한 연구 및 개발에는 전체 구조, 표면 토폴로지, 재료 및 코팅 적용에 대한 변형을 포함한 다양한 전략이 포함되었습니다. 이러한 노력은 이식 이벤트로부터 지속되는 손상을 최소화하고, 장치와 근위 세포 사이에 보다 유리한 계면을 도입하거나, 장치가 이식된 후 조직 변형을 감소시키려는 의도(7)를 의도한다. 만성 생물학적 반응을 구체적으로 표적으로 하는 방법은 이식 부위를 안정화시키고 세포 건강을 화학적으로 증진시키는 것을 목표로 하는 몇몇 생리활성 코팅을 유도하였다. 그 예로는 전도성 중합체, 예컨대 폴리(에틸렌 디옥시티오펜)(PEDOT)19,20, 탄소 나노튜브 21, 하이드로겔 22, 및 특정 세포 공정 23,24,25를 표적화하기 위해 생체활성 분자 및 약물의 첨가를 포함한다. 우리의 연구 그룹은 특히 장치 이식 26과 관련된 외상을 최소화하고, 장치 / 조직 경직성 불일치를 최소화하고, 27,28,29,30,31,32,33, 살균을 최적화하는 것을 포함하되 이에 국한되지 않는 이식 된 미세 전극에 대한 염증 반응의 감소를 촉진하기위한 많은 메커니즘을 탐구했습니다. 절차 34,35, 산화 응력/손상 감소 28,36,37,38,39,40,41,42, 대체 전극 재료(43) 탐구, 천연 세포외 매트릭스의 나노 아키텍처 모방 44,45,46 . 최근의 관심은 미세전극 조직 계면(39)에서 신경염증 반응을 직접 완화시키기 위한 생체모방 표면 코팅의 개발이다.
인터페이스의 변형은 신호 기록에 필요한 상처 및 근위 조직을 직접 타겟팅하는 독특한 이점을 제공합니다. 면역 반응을 악화시키지 않고 치유를 촉진하는 표면 처리는 품질 기록의 수명에 도움이 될 수 있으며 피질 내 미세 전극의 치료 및 연구 잠재력을 실현하는 데 한계를 제거 할 수 있습니다. 제시된 작업은 장치의 취약성을 수용하면서 연장 된 반응 시간을 필요로하는 마이크로 전극 어레이에 표면 처리를 적용하는 방법을 자세히 설명합니다. 제시된 기술은 표면 개질 방법을 치료 응용 분야 전반에 걸쳐 장치를 처리 할 수없는 기능 장치와 공유하기위한 것입니다. 이 도구는 비기능성 더미 프로브 및 기능성 실리콘 평면 마이크로 전극 어레이를 처리하기 위해 제공됩니다.
전극 표면을 변형시키기 위한 제시된 접근법은 기상 증착 및 수용액과의 반응을 위한 비작용성 더미 프로브 또는 기능성 실리콘 평면 전극 어레이의 안전한 현탁액을 허용한다. 이러한 깨지기 쉬운 장치를 처리하는 데 여러 3D 인쇄 조각이 사용됩니다(그림 1 및 그림 2). Mn(III)테트라키스(4-벤조산)포르피린(MnTBAP)의 고정화를 수반하는 산화방지 코팅을 이용한 표면 개질을 위한 가스 및 용액 상 단계 둘 다를 활용하는 절차의 예가 제공된다. MnTBAP는 염증47,48의 중재가 입증 된 항산화 특성을 지닌 합성 메탈로 포르피린입니다. 기능성 실리콘 평면 전극 어레이 상의 제공된 예는 비기능성 장치(40)에 대해 이전에 보고된 프로토콜에 대한 업데이트를 검증한다. Munief et al.로부터의 기상 증착 기술의 적응은 기능성 전극들(49)과의 프로토콜의 상용성을 지지한다. 기상증착은 활성 MnTBAP를 고정화하기 위해 카르보디이미드 가교결합제 화학을 수반하는 수성 반응에 대비하여 아민 작용화 표면을 기능화하는데 이용된다. 여기서 개발된 취급 방법론은 다른 코팅 및 유사한 장치를 수용하도록 변형될 수 있는 플랫폼으로서 제공된다.
이 프로토콜은 기능성 실리콘 평면 전극 어레이와 유사한 치수의 실리콘 생크 및 3D 프린팅된 탭을 포함하는 비기능성 더미 프로브를 사용하는 접근법을 예시한다. 장치의 커넥터 패키징은 제공된 지침에서 작동하지 않는 더미 프로브의 3D 인쇄 탭과 유사한 것으로 간주됩니다.
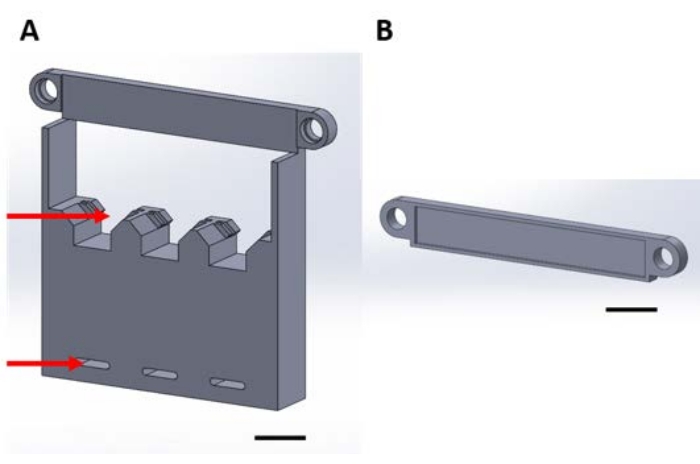
그림 1: 진공 데시케이터에서 기상 증착 시 기능 장치를 취급하기 위한 3D 인쇄물 . (A) 구조물의 베이스에는 1cm x 1cm 샘플 실리콘 사각형용 홀더(상단 화살표)와 데시케이터 플레이트에 고정하기 위한 구멍(하단 화살표)이 포함됩니다. (B) 플레이트는 장치의 서스펜션을 고정하는 데 사용됩니다. 여기서부터이 그림의 각 조각은 조각 1A 또는 1B라고합니다. 배율 막대 = 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
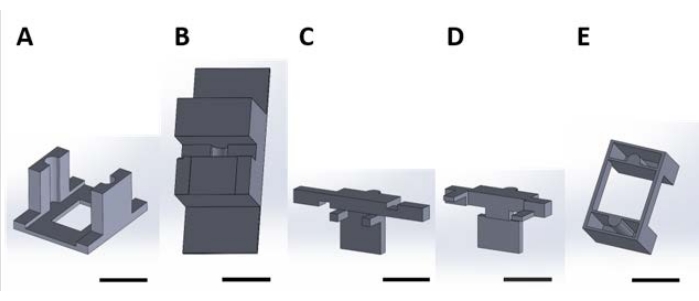
도 2: 수용액에서 발생하는 표면 반응을 위한 기능성 장치를 취급하기 위한 3D 인쇄물. (A) 배양 플레이트의 뚜껑에 접착되는 가이드 피스. (B) 조립하는 동안 조각 (C)와 (D)를 안정화시키는 데 사용되는 벤치 탑 조각. (C) 및 (D)는 웰 플레이트 내에 배치하기 위한 디바이스의 현탁액을 함께 고정하고, (E) 피스 (C) 및 (D)를 웰 플레이트 뚜껑에 추가로 고정시킨다. 여기서부터이 그림의 각 패널에있는 개별 조각은이 그림의 패널 번호에 해당하는 조각 번호라고합니다. 배율 막대 = 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
기술된 프로토콜은 실리콘 평면 마이크로전극 어레이의 표면 처리를 위해 설계되었다. 3D 프린팅된 툴은 로우 프로파일 커넥터(50)를 갖는 미시간 스타일의 마이크로전극 어레이에 맞게 맞춤화된다. 비기능성 프로브는 생체적합성 접착제를 사용하여 실리콘 프로브를 3D 프린트된 탭에 부착하여 조립하였다. 3D 인쇄 탭은 사용 가능한 상용 장치에 통합 된 커넥터와 비슷한 크기로 ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 연구는 미국 (미국) 재향 군인 업무 재활 연구 개발 서비스의 Merit Review Award IRX002611 (Capadona) 및 Research Career Scientist Award IK6RX003077 (Capadona)에 의해 부분적으로 지원되었습니다. 또한이 연구는 국립 보건 연구소, 국립 신경 장애 및 뇌졸중 연구소 R01NS110823 (Capadona / Pancrazio) 및 국립 과학 재단 대학원 연구 펠로우십 프로그램 (Krebs)의 일부 지원을받습니다.
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

