Ferramentas para tratamento superficial de microeletroletos intracorticais planar de silício
Summary
O presente protocolo descreve ferramentas para o manuseio de microeletroletos intracorticais planar de silício durante os tratamentos para modificação superficial via deposição de gás e reações de soluções aquosas. A montagem dos componentes utilizados para manusear os dispositivos durante todo o procedimento é explicada detalhadamente.
Abstract
Microeletrões intracorticais possuem grande potencial terapêutico. Mas eles são desafiados com redução significativa de desempenho após modestas durações de implantação. Um contribuinte substancial para o declínio observado é o dano ao tecido neural proximal ao implante e resposta neuroinflamatória subsequente. Os esforços para melhorar a longevidade do dispositivo incluem modificações químicas ou aplicações de revestimento na superfície do dispositivo para melhorar a resposta do tecido. O desenvolvimento desses tratamentos superficiais é tipicamente concluído usando sondas “manequim” não funcionais que não possuem os componentes elétricos necessários para a aplicação pretendida. A tradução para dispositivos funcionais requer consideração adicional dada a fragilidade dos arrays de microeletrodos intracorticais. Ferramentas de manuseio facilitam muito os tratamentos superficiais para dispositivos montados, particularmente para modificações que requerem longos tempos processuais. As ferramentas de manuseio descritas aqui são utilizadas para tratamentos superficiais aplicados via deposição em fase de gás e exposição aquosa de soluções. A caracterização do revestimento é realizada utilizando elipsometry e espectroscopia de fotoeletrões de raios-X. Uma comparação das gravações de espectroscopia de impedância elétrica antes e depois do procedimento de revestimento em dispositivos funcionais confirmou a integridade do dispositivo após a modificação. As ferramentas descritas podem ser prontamente adaptadas para dispositivos eletrodos alternativos e métodos de tratamento que mantenham a compatibilidade química.
Introduction
Os dispositivos neuroprostéticos visam restaurar as habilidades sensoriais e motoras prejudicadas ou ausentes em uma ampla gama de populações de pacientes, incluindo aqueles com lesão medular, Esclerose Lateral Amiotrófica (ELA), paralisia cerebral e amputações 1,2,3. Microeletrodes intracorticais (IMEs) podem estabelecer uma via de comunicação entre neurônios corticais e os dispositivos usados para controlar a neuroprótese. Uma vantagem distinta dos microeletrodos intracorticais é sua capacidade de registrar sinais neurais na alta resolução espacial e temporal, que é preferida para processamento e controle subsequente de sinais de interfaces cérebro-computador 4,5. Infelizmente, o desempenho das microeletragens intracorticais reduz drasticamente em meses para um ano após a implantação 2,6,7,8. A perda de qualidade e estabilidade do sinal afeta negativamente a aplicação da tecnologia.
Um contribuinte significativo para o declínio de desempenho observado é a resposta biótica aos danos teciduais associados à implantação e à neuroinflamação crônica 9,10,11. A implantação de IMEs inflige danos no tecido cerebral, resultando na liberação de moléculas de sinalização que iniciam cascatas de processos reacionários de defesa celular. O interligamento crônico exacerba a resposta do corpo estranho, levando à neuroinflamação sustentada que danifica o tecido proximal ao dispositivo; muitas vezes reconhecidos como sintomas de neuroinflamação, cicatrizes e neurodegeneração local contribuindo para o declínio do registro da qualidade do sinal 12,13,14,15. Compreendendo um denso conglomerado de astrócitos com microglia ativada e macrófagos, a cicatriz que encapsula o eletrodo cria um ambiente local desfavorável com redução do transporte material e acúmulo local de fatores inflamatórios 16,15,16,17,18.
Muitos estudos descreveram a resposta do cérebro a microeletrodos intracorticais ou abordagens para mitigar a resposta7. A pesquisa e o desenvolvimento para melhorar a resposta tecidual envolveram uma série de estratégias, incluindo modificações na estrutura geral, topologia superficial, materiais e aplicação de revestimentos. Esses esforços visam minimizar os danos sofridos a partir do evento de implantação, introduzir uma interface mais favorável entre o dispositivo e as células proximais, ou reduzir a tensão tecidual após o implantedos dispositivos 7. Métodos especificamente voltados para a resposta biológica crônica levaram a vários revestimentos bioativos que visam estabilizar o local de implantação e promover quimicamente a saúde celular. Exemplos incluem polímeros condutores como poli (etileno dioxythiophene) (PEDOT)19,20, nanotubosde carbono 21, hidrogéis22 e a adição de moléculas bioativas e drogas para atingir processos celulares específicos 23,24,25. Nosso grupo de pesquisa, em particular, explorou muitos mecanismos para promover a redução da resposta inflamatória aos microeletrodos implantados, incluindo, mas não se limitando a, minimizar o trauma associado à implantação do dispositivo26, minimizando a incompatibilidade de dispositivo/rigidez tecidual 27,28,29,30,31,32, otimizando a esterilização procedimentos34,35, reduzindo o estresse/dano oxidativo 28,36,37,38,39,40,41,42, explorando materiais eletrodos alternativos43, e imitando a nanoarestares da matriz extracelular natural 44,45,46 . Interesse recente é o desenvolvimento de revestimentos biomiméticos de superfície para mitigar a resposta neuroinflamatória na interface tecidual microeletrodes diretamente39.
A modificação da interface oferece o benefício único de direcionar diretamente a ferida e o tecido proximal necessário para a gravação do sinal. Um tratamento superficial que promova a cura sem exacerbar a resposta imune pode beneficiar a vida útil do registro de qualidade e remover limitações na realização do potencial terapêutico e de pesquisa de microeletros intracorticais. O trabalho apresentado detalha métodos para a aplicação de tratamentos superficiais em matrizes de microeletrodos que requerem tempos de reação prolongados, acomodando a fragilidade dos dispositivos. A técnica apresentada destina-se a compartilhar métodos de modificação de superfície em dispositivos funcionais onde o dispositivo não pode ser manuseado durante toda a aplicação do tratamento. As ferramentas são apresentadas para o manuseio de sondas manequim não funcionais e matrizes de microeletrodos planar de silício funcionais.
A abordagem apresentada para modificar a superfície do eletrodo permite a suspensão segura de sondas manequim não funcionais ou conjuntos funcionais de eletrodos planar de silício para deposição em fase de gás e reação com soluções aquosas. Várias peças impressas em 3D são usadas para lidar com esses dispositivos frágeis (Figura 1 e Figura 2). Um exemplo é fornecido de um procedimento que utiliza etapas de fase de gás e solução para a modificação da superfície com um revestimento antioxidativo envolvendo a imobilização da porfirina Mn(III)tetrakis (ácido 4-benzoico) (MnTBAP). MnTBAP é uma metalloporfirina sintética que possui propriedades antioxidantes com mediação demonstrada de inflamação47,48. O exemplo fornecido em matrizes funcionais de eletrodos planar de silício valida uma atualização para um protocolo previamente relatado para dispositivos não funcionais40. A adaptação de uma técnica de deposição de fase de gás da Munief et al. suporta a compatibilidade do protocolo com eletrodos funcionais49. A deposição da fase gasosa é utilizada para amina funcionalizar a superfície em preparação para a reação aquosa envolvendo a química do crosslinker carbodiimide para imobilizar o MnTBAP ativo. A metodologia de manuseio desenvolvida aqui é fornecida como uma plataforma que pode ser modificada para acomodar outros revestimentos e dispositivos similares.
O protocolo ilustra a abordagem usando sondas manequim não funcionais que compreendem uma haste de silício e uma guia impressa em 3D com dimensões semelhantes às matrizes funcionais de eletrodos planar de silício. A embalagem do conector do dispositivo é considerada análoga à guia impressa 3D da sonda manequim não funcional na instrução fornecida.
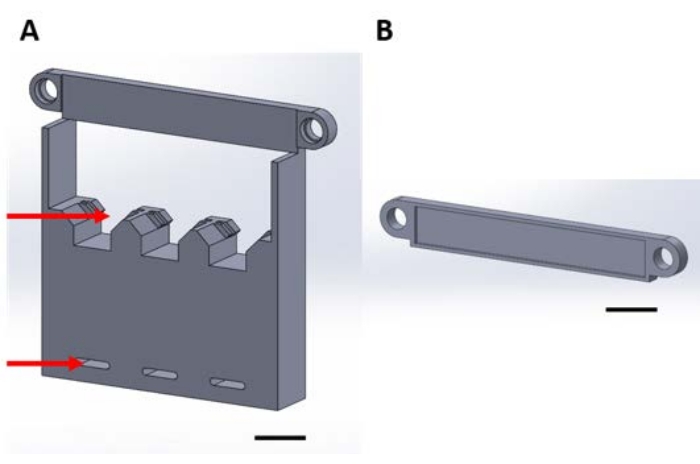
Figura 1: Peças impressas em 3D para manuseio de dispositivos funcionais durante a deposição em fase de gás em um desiccator a vácuo. (A) A base da estrutura inclui suportes para quadrados de silício de amostra de 1 cm x 1 cm (seta superior) e orifícios para fixação na placa desiccator (seta inferior). (B) A placa é usada para fixar a suspensão dos dispositivos. Daqui em diante, cada peça desta figura será referida como peça 1A ou 1B. Barra de escala = 1 cm. Clique aqui para ver uma versão maior desta figura.
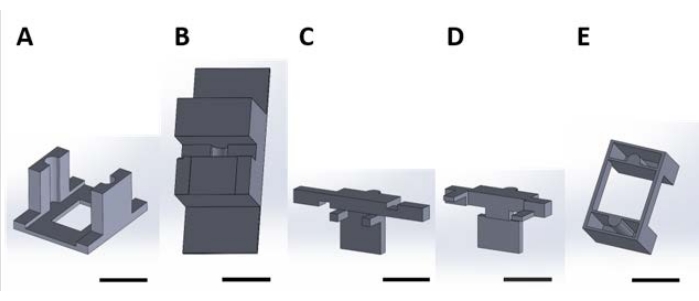
Figura 2: Peças impressas em 3D para manuseio de dispositivos funcionais para a reação superficial que ocorre na solução aquosa. (A) Peça guia a ser colada à tampa da placa de cultura. (B) Peças benchtop usadas para estabilizar peças (C) e (D) durante a montagem. (C) e (D) juntos fixam a suspensão dos dispositivos para colocação na placa do poço, e (E) segura ainda mais as peças (C) e (D) na tampa da placa do poço. A partir de agora, as peças individuais em cada painel desta figura serão referidas como números de peça correspondentes ao número do painel desta figura. Barra de escala = 1 cm. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O protocolo descrito foi projetado para o tratamento superficial de matrizes de microeletrodos planar de silício. As ferramentas impressas em 3D são personalizadas para matrizes de microeletrodos estilo Michigan com conectores de baixo perfil50. As sondas não funcionais foram montadas aderindo uma sonda de silício a guias impressas em 3D usando um adesivo biocompatível. As guias impressas em 3D foram projetadas com dimensões semelhantes aos conectores incorporados nos dispositivos disponíve…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este estudo foi apoiado em parte pelo Merit Review Award IRX002611 (Capadona) e pelo Research Career Scientist Award IK6RX003077 (Capadona) do Departamento de Pesquisa e Desenvolvimento de Assuntos de Veteranos dos Estados Unidos (EUA). Além disso, este trabalho também contou com o apoio, em parte, do Instituto Nacional de Saúde, Instituto Nacional de Distúrbios Neurológicos e AVC R01NS110823 (Capadona/Pancrazio) e do Programa nacional de Bolsas de Pós-Graduação em Pesquisa (Krebs).
Materials
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of ‘chronic’ for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).

