إزالة العين في يرقات الزرد الحية لفحص النمو والتطور المعتمد على التعصيب للنظام البصري
Summary
يشرح المقال كيفية إزالة العينين جراحيا من يرقات الزرد الحية كخطوة أولى نحو التحقيق في كيفية تأثير مدخلات الشبكية على نمو التكتوم البصري وتطوره. بالإضافة إلى ذلك ، توفر المقالة معلومات حول تخدير اليرقات وتثبيتها وتشريح الدماغ ، تليها الكيمياء النسيجية المناعية والتصوير البؤري.
Abstract
تظهر أسماك الزرد نموا ملحوظا مدى الحياة وقدرات تجديدية. على سبيل المثال، تدعم منافذ الخلايا الجذعية المتخصصة التي تم إنشاؤها أثناء التكوين الجنيني النمو المستمر للنظام البصري بأكمله، سواء في العين أو الدماغ. يضمن النمو المنسق بين الشبكية والتكتوم البصري رسم خرائط دقيقة للشبكية مع إضافة خلايا عصبية جديدة في العينين والدماغ. لمعالجة ما إذا كانت محاور الشبكية توفر معلومات حاسمة لتنظيم سلوكيات الخلايا الجذعية التكتالية والسلف مثل البقاء على قيد الحياة والانتشار و / أو التمايز ، من الضروري أن تكون قادرا على مقارنة الفصوص التكتالية المعصبة والمتوترة داخل نفس الحيوان وعبر الحيوانات.
الاستئصال الجراحي لعين واحدة من الزرد اليرقي الحي تليها مراقبة التكتوم البصري يحقق هذا الهدف. يوضح الفيديو المصاحب كيفية تخدير اليرقات ، وشحذ إبر التنغستن كهربائيا ، واستخدامها لإزالة عين واحدة. ويوضح بعد ذلك كيفية تشريح الأدمغة من يرقات الزرد الثابتة. وأخيرا، يقدم الفيديو لمحة عامة عن بروتوكول الكيمياء النسيجية المناعية وعرضا توضيحيا لكيفية تركيب الأجنة الملطخة في الأغاروز منخفض درجة الانصهار للفحص المجهري.
Introduction
الهدف من هذه الطريقة هو التحقيق في كيفية تأثير مدخلات الشبكية على نمو وتطور التكتوم البصري ، وهو مركز المعالجة البصرية في دماغ الزرد. من خلال إزالة عين واحدة ثم مقارنة جانبي التكتوم البصري ، يمكن ملاحظة التغيرات التكتالية داخل نفس العينة وتطبيعها ، مما يتيح المقارنة عبر عينات متعددة. سوف تسفر الأساليب الجزيئية الحديثة جنبا إلى جنب مع هذه التقنية عن رؤى ثاقبة حول الآليات الكامنة وراء نمو النظام البصري وتطوره ، بالإضافة إلى الانحطاط والتجديد المحوري.
تجمع الأنظمة الحسية – البصرية والسمعية والحسية الجسدية – المعلومات من الأعضاء الخارجية وتنقل تلك المعلومات إلى الجهاز العصبي المركزي ، وتولد “خرائط” للعالم الخارجي عبر الدماغ المتوسط 1,2. الرؤية هي الطريقة الحسية السائدة لجميع الفقاريات تقريبا ، بما في ذلك العديد من الأسماك. تجمع شبكية العين، وهي النسيج العصبي في العين، المعلومات مع دائرة عصبية تتكون في المقام الأول من المستقبلات الضوئية، والخلايا ثنائية القطب، وخلايا العقدة الشبكية (RGCs)، وهي الخلايا العصبية الإسقاط في شبكية العين. تحتوي RGCs على محاور طويلة تجد طريقها عبر السطح الداخلي للشبكية إلى رأس العصب البصري ، حيث تبهر وتنتقل معا عبر الدماغ ، وتنتهي في النهاية في مركز المعالجة البصرية في الدماغ المتوسط الظهري. ويسمى هذا الهيكل التكتوم البصري في الأسماك وغيرها من الفقاريات غير الثدييات وهو متجانس مع كوليكولوس متفوقة في الثدييات3.
التكتوم البصري هو بنية متعددة الطبقات متماثلة ثنائيا في الدماغ المتوسط الظهري. في أسماك الزرد ومعظم الأسماك الأخرى ، يتلقى كل فص من التكتوم البصري مدخلات بصرية فقط من العين المقابلة ، بحيث ينتهي العصب البصري الأيسر في الفص التكتال الأيمن وينتهي العصب البصري الأيمن في الفص التكتالي الأيسر4 (الشكل 1). مثل نظيره الثدييات ، كوليكولوس المتفوق ، يدمج التكتوم البصري المعلومات البصرية مع المدخلات الحسية الأخرى ، بما في ذلك الاختبار والإحساس الجسدي ، والتحكم في التحولات في الانتباه البصري وحركات العين مثل saccades 1,5,6. ومع ذلك ، على عكس كوليكولوس الثدييات العليا ، فإن التكتوم البصري يولد باستمرار خلايا عصبية ودبقية جديدة من مكانة الخلايا الجذعية المتخصصة بالقرب من الحواف الإنسية والذيلية للفصوص التكتالية التي تسمى منطقة الانتشار التكتالي7. تساهم صيانة السلف التكاثرية في التكتوم البصري ومناطق أخرى من الجهاز العصبي المركزي ، جزئيا ، في القدرة التجديدية الرائعة الموثقة في الزرد8.
كشفت الأبحاث السابقة التي فحصت أدمغة الأسماك العمياء أو ذات العين الواحدة أن حجم التكتوم البصري يتناسب طرديا مع كمية تعصيب الشبكية التي يتلقاها9،10،11. في أسماك الكهوف البالغة ، التي تتدهور عيونها في التكوين الجنيني المبكر ، يكون التكتوم البصري أصغر بشكل ملحوظ من الأسماك السطحية المبصرة ذات الصلة الوثيقة9. يمكن منع تنكس عين سمكة الكهف عن طريق استبدال العدسة الداخلية بعدسة من سمكة سطحية أثناء التكوين الجنيني. عندما يتم تربية أسماك الكهوف ذات العين الواحدة هذه حتى مرحلة البلوغ ، يحتوي الفص التكتال المعصب على خلايا أكثر بنسبة 10٪ تقريبا من الفص التكتال غير المعصب9. وبالمثل ، في أسماك اليرقات اليرقات التي تم احتضانها بعلاجات كيميائية لتوليد عيون بأحجام مختلفة داخل نفس الفرد ، كان جانب التكتوم مع المزيد من التعصيب أكبر ويحتوي على المزيد من الخلايا العصبية10. تشير الأدلة المستقاة من تجارب سحق العصب البصري في الأسماك الذهبية البالغة إلى أن التعصيب يعزز الانتشار ، مع انخفاض تكاثر الخلايا التكتالية عندما تعطل التعصيب11.
وتأكيدا لهذه الدراسات الكلاسيكية وتوسيعها، تقدم العديد من التقارير الحديثة بيانات تشير إلى أن الانتشار استجابة للتعصيب يتم تعديله، جزئيا على الأقل، من خلال مسار BDNF-TrkB12,13. لا تزال هناك العديد من الأسئلة المفتوحة حول نمو التكتوم البصري وتطوره ، بما في ذلك كيفية تعامل النظام الحسي النامي مع الإصابة وانحطاط المحور العصبي ، والإشارات الخلوية والجزيئية التي تمكن مدخلات الشبكية من تنظيم نمو التكتوم البصري ، ومتى تصبح هذه الآليات نشطة ، وما إذا كان الانتشار والتمايز المرتبطان بالتعصيب يمكنان شبكية العين وأنسجتها المستهدفة من تنسيق معدلات النمو وضمان رسم خرائط دقيقة للشبكية الشبكية. بالإضافة إلى ذلك ، هناك أسئلة أكبر بكثير حول التطور المعتمد على النشاط والتي يمكن معالجتها عن طريق استجواب النظام البصري لأسماك الزرد باستخدام الأساليب الجراحية مثل تلك الموضحة أدناه.
للتحقيق في الآليات الخلوية والجزيئية التي يغير بها النشاط العصبي ، وتحديدا من المدخلات البصرية ، بقاء الخلايا وانتشارها ، يقارن النهج الموصوف مباشرة الفصوص التكتالية المعصبة والمشوهة (الشكل 1) داخل يرقات الزرد الفردية. تسمح هذه الطريقة بتوثيق تنكس محور RGC في التكتوم البصري وتأكيد أن عدد الخلايا الانقسامية يرتبط بالتعصيب.
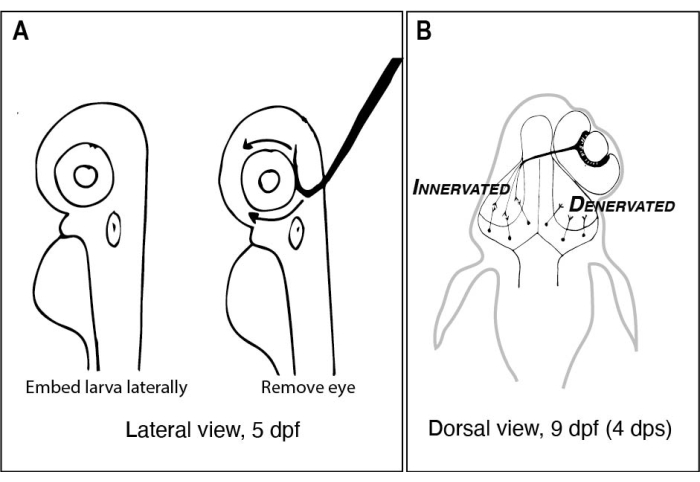
الشكل 1: رسومات ليرقات الزرد قبل وبعد إزالة العين من جانب واحد . (أ) رسم يرقات 5 dpf كما ينظر إليها تحت المجهر تشريح. يتم تضمين كل يرقة في الأغاروز منخفض الانصهار وتوجيهها أفقيا قبل استخدام إبرة التنغستن ذات الطرف الحاد المدمن على المخدرات لإخراج العين متجهة لأعلى (العين اليسرى في هذا المثال). (ب) رسم المنظر الظهري ليرقة 9 dpf الناتجة عن الجراحة الموضحة في A. تظهر ثلاثة محاور RGC عالية التخطيط فقط من العين اليمنى وهي تزيل اللفافة وتتصل بالخلايا العصبية في الفص التكتالي الأيسر. الاختصارات: dpf = أيام بعد الإخصاب ؛ dps = أيام ما بعد الجراحة; RGC = خلايا العقدة الشبكية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
توضح التقنيات الموصوفة في هذه الورقة واحدة من العديد من الطرق لدراسة تطور النظام البصري للفقاريات في أسماك الزرد. نشر باحثون آخرون طرقا لتشريح الشبكية الجنينية وإجراء تحليلات التعبير الجيني19 أو تصور النشاط العصبي في التكتوم البصري30. تقدم هذه الورقة نهجا لاستكش?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
تم دعم تمويل هذا العمل في المقام الأول من خلال أموال بدء التشغيل من كلية ريد إلى KLC ، وأموال زمالة هيلين ستافورد للأبحاث إلى OLH ، وزمالة أبحاث العلوم في كلية ريد إلى YK. بدأ هذا المشروع في مختبر ستيف ويلسون كتعاون مع الموارد البشرية ، الذي تم دعمه من قبل Wellcome Trust Studentship (2009-2014). نشكر ماتي فارغا وستيف ويلسون وأعضاء آخرين في مختبر ويلسون على المناقشات الأولية حول هذا المشروع ، ونشكر بشكل خاص فلورنسيا كافوداسي وكيت إدواردز ، الذين كانوا أول من علم KLC كيفية تركيب الأجنة في الأغاروز وإجراء تشريح دماغ الزرد. كما نشكر غريتا غلوفر وجاي إيوينغ على المساعدة في تجميع جهاز شحذ إبرة التنغستن.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
References
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

