Oogverwijdering bij levende zebravislarven om innervatie-afhankelijke groei en ontwikkeling van het visuele systeem te onderzoeken
Summary
Het artikel legt uit hoe de ogen chirurgisch kunnen worden verwijderd van levende zebravislarven als de eerste stap om te onderzoeken hoe retinale input de groei en ontwikkeling van het optische tectum beïnvloedt. Daarnaast biedt het artikel informatie over larvale anesthesie, fixatie en hersendissectie, gevolgd door immunohistochemie en confocale beeldvorming.
Abstract
Zebravissen vertonen opmerkelijke levenslange groei en regeneratieve vermogens. Gespecialiseerde stamcelniches die tijdens embryogenese zijn vastgesteld, ondersteunen bijvoorbeeld de continue groei van het hele visuele systeem, zowel in het oog als in de hersenen. Gecoördineerde groei tussen het netvlies en het optische tectum zorgt voor nauwkeurige retinotopische mapping als nieuwe neuronen worden toegevoegd in de ogen en hersenen. Om na te gaan of retinale axonen cruciale informatie leveren voor het reguleren van tectale stam- en voorlopercelgedrag zoals overleving, proliferatie en / of differentiatie, is het noodzakelijk om geïnnerveerde en gedenerveerde tectale kwabben binnen hetzelfde dier en tussen dieren te kunnen vergelijken.
Chirurgische verwijdering van één oog van levende larvale zebravissen gevolgd door observatie van het optische tectum bereikt dit doel. De bijbehorende video laat zien hoe je larven kunt verdoven, wolfraamnaalden elektrolytisch kunt slijpen en ze kunt gebruiken om één oog te verwijderen. Het laat vervolgens zien hoe hersenen van vaste zebravislarven kunnen worden ontleed. Ten slotte biedt de video een overzicht van het protocol voor immunohistochemie en een demonstratie van het monteren van gekleurde embryo’s in agarose met een laag smeltpunt voor microscopie.
Introduction
Het doel van deze methode is om te onderzoeken hoe retinale input de groei en ontwikkeling van het optische tectum, het visuele verwerkingscentrum in het zebravisbrein, beïnvloedt. Door één oog te verwijderen en vervolgens de twee zijden van het optische tectum te vergelijken, kunnen tectale veranderingen binnen hetzelfde monster worden waargenomen en genormaliseerd, waardoor vergelijking tussen meerdere monsters mogelijk is. Moderne moleculaire benaderingen in combinatie met deze techniek zullen inzicht geven in de mechanismen die ten grondslag liggen aan de groei en ontwikkeling van visuele systemen, evenals axonale degeneratie en regeneratie.
Sensorische systemen – visueel, auditief en somatosensorisch – verzamelen informatie van externe organen en geven die informatie door aan het centrale zenuwstelsel, waardoor “kaarten” van de externe wereld in de middenhersenen worden gegenereerd 1,2. Visie is de dominante sensorische modaliteit voor bijna alle gewervelde dieren, inclusief veel vissen. Het netvlies, het neurale weefsel in het oog, verzamelt informatie met een neuronaal circuit dat voornamelijk bestaat uit fotoreceptoren, bipolaire cellen en retinale ganglioncellen (RGC’s), de projectieneuronen van het netvlies. RGC’s hebben lange axonen die hun weg vinden over het binnenoppervlak van het netvlies naar de oogzenuwkop, waar ze fasciculeren en samen door de hersenen reizen, uiteindelijk eindigend in het visuele verwerkingscentrum in de dorsale middenhersenen. Deze structuur wordt het optische tectum genoemd bij vissen en andere niet-zoogdiergewervelde dieren en is homoloog aan de superieure colliculus bij zoogdieren3.
Het optische tectum is een bilateraal symmetrische meerlagige structuur in de dorsale middenhersenen. Bij zebravissen en de meeste andere vissen ontvangt elke kwab van het optische tectum alleen visuele input van het contralaterale oog, zodat de linker oogzenuw eindigt in de rechter tectale kwab en de rechter oogzenuw eindigt in de linker tectalkwab4 (figuur 1). Net als zijn tegenhanger bij zoogdieren, de superieure colliculus, integreert het optische tectum visuele informatie met andere sensorische inputs, waaronder auditie en somatosensatie, waarbij verschuivingen in visuele aandacht en oogbewegingen zoals saccades 1,5,6 worden geregeld. In tegenstelling tot de superieure colliculus van zoogdieren genereert het optische tectum echter voortdurend nieuwe neuronen en glia uit een gespecialiseerde stamcelniche in de buurt van de mediale en caudale randen van de tectale kwabben die de tectale proliferatiezone7 worden genoemd. Het behoud van proliferatieve voorlopercellen in het optische tectum en andere regio’s van het centrale zenuwstelsel draagt gedeeltelijk bij aan de opmerkelijke regeneratieve capaciteit die is gedocumenteerd bij zebravissen8.
Eerder onderzoek naar de hersenen van blinde of eenogige vissen onthulde dat de grootte van het optische tectum recht evenredig is met de hoeveelheid retinale innervatie die het ontvangt 9,10,11. Bij volwassen grotvissen, waarvan de ogen degenereren in vroege embryogenese, is het optische tectum merkbaar kleiner dan dat van nauw verwante, waargenomen oppervlaktevissen9. Cave fish eye degeneratie kan worden geblokkeerd door de endogene lens te vervangen door een lens van een oppervlaktevis tijdens embryogenese. Wanneer deze eenogige grotvissen volwassen worden gemaakt, bevat de geïnnerveerde tectale kwab ongeveer 10% meer cellen dan de niet-geïnnerveerde tectale kwab9. Evenzo was bij larvale killivissen die werden geïncubeerd met chemische behandelingen om ogen van verschillende groottes binnen hetzelfde individu te genereren, de kant van het tectum met meer innervatie groter en bevatte meer neuronen10. Bewijs van oogzenuwverpletteringsexperimenten bij volwassen goudvissen geeft aan dat innervatie proliferatie bevordert, waarbij de proliferatie van tectale cellen afneemt wanneer innervatie werd verstoord11.
Om deze klassieke studies te bevestigen en uit te breiden, bieden verschillende recente rapporten gegevens die suggereren dat proliferatie in reactie op innervatie, althans gedeeltelijk, wordt gemoduleerd door de BDNF-TrkB-route12,13. Veel open vragen over de groei en ontwikkeling van optische tectum blijven bestaan, waaronder hoe een zich ontwikkelend sensorisch systeem omgaat met letsel en axondegeneratie, welke cellulaire en moleculaire signalen retinale input mogelijk maken om de groei van het optische tectum te reguleren, wanneer deze mechanismen actief worden, en of innervatie-gekoppelde proliferatie en differentiatie het netvlies en zijn doelweefsel in staat stellen om groeisnelheden te coördineren en nauwkeurige retinotopische mapping te garanderen. Bovendien zijn er veel grotere vragen over activiteitsafhankelijke ontwikkeling die kunnen worden aangepakt door het visuele systeem van zebravissen te ondervragen met chirurgische benaderingen zoals hieronder beschreven.
Om de cellulaire en moleculaire mechanismen te onderzoeken waarmee neurale activiteit, met name uit visuele input, de overleving en proliferatie van cellen verandert, vergelijkt de beschreven benadering direct geïnnerveerde en gedenervateerde tectale kwabben (figuur 1) binnen individuele zebravislarven. Deze methode maakt het mogelijk om RGC axondegeneratie in het optische tectum te documenteren en te bevestigen dat het aantal mitotische cellen correleert met innervatie.
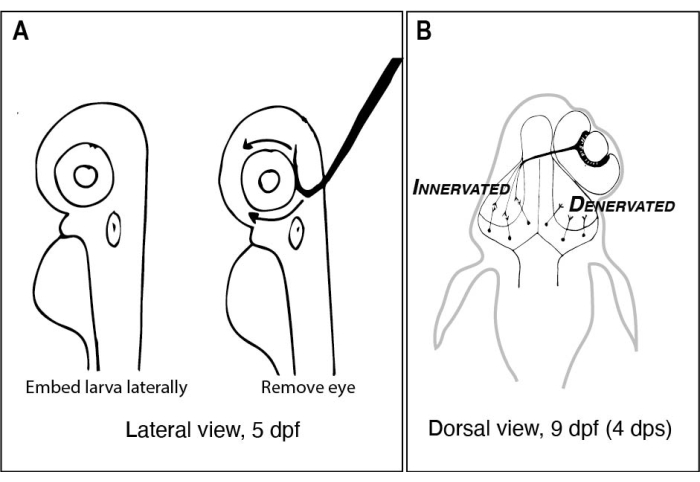
Figuur 1: Schetsen van zebravislarven voor en na eenzijdige oogverwijdering. (A) Tekening van 5 dpflarven gezien onder een ontleedmicroscoop. Elke larve is ingebed in agarose met een laag smeltpunt en zijdelings georiënteerd voordat een wolfraamnaald met een scherpe, gehaakte punt wordt gebruikt om het oog naar boven te scheppen (linkeroog in dit voorbeeld). (B) Tekening van het dorsale beeld van een larve van 9 dpf als gevolg van de in A afgebeelde operatie. Slechts drie sterk geschematiseerde RGC-axonen uit het rechteroog worden getoond die zich defasciculeren en verbinden met neuronen in de linker tectalkwab. Afkortingen: dpf = dagen na de bevruchting; dps = dagen na de operatie; RGC = retinale ganglioncellen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De technieken die in dit artikel worden beschreven, illustreren een van de vele benaderingen voor het bestuderen van de ontwikkeling van visuele systemen van gewervelde dieren bij zebravissen. Andere onderzoekers hebben methoden gepubliceerd om het embryonale netvlies te ontleden en genexpressieanalyses19 uit te voeren of neuronale activiteit in het optische tectum30 te visualiseren. Dit artikel biedt een benadering voor het onderzoeken hoe differentiële retinale input het…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Financiering voor dit werk werd voornamelijk ondersteund door start-upfondsen van Reed College tot KLC, Helen Stafford Research Fellowship-fondsen tot OLH en een Reed College Science Research Fellowship tot YK. Dit project begon in het lab van Steve Wilson als een samenwerking met HR, die werd ondersteund door een Wellcome Trust Studentship (2009-2014). We bedanken Máté Varga, Steve Wilson en andere leden van het Wilson-lab voor de eerste discussies over dit project, en we bedanken in het bijzonder Florencia Cavodeassi en Kate Edwards, die KLC als eersten leerden hoe ze embryo’s in agarose konden monteren en hersendissecties van zebravissen konden uitvoeren. We bedanken ook Greta Glover en Jay Ewing voor hun hulp bij het in elkaar zetten van ons wolfraam naaldslijpapparaat.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
References
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

