Enlèvement des yeux chez les larves vivantes de poisson zèbre pour examiner la croissance et le développement du système visuel dépendants de l’innervation
Summary
L’article explique comment enlever chirurgicalement les yeux des larves vivantes de poisson zèbre comme première étape vers l’étude de la façon dont l’apport rétinien influence la croissance et le développement du tectum optique. En outre, l’article fournit des informations sur l’anesthésie larvaire, la fixation et la dissection cérébrale, suivies de l’immunohistochimie et de l’imagerie confocale.
Abstract
Les poissons-zèbres présentent une croissance et des capacités de régénération remarquables tout au long de la vie. Par exemple, les niches de cellules souches spécialisées établies au cours de l’embryogenèse favorisent la croissance continue de l’ensemble du système visuel, à la fois dans l’œil et le cerveau. La croissance coordonnée entre la rétine et le tectum optique assure une cartographie rétinotopique précise à mesure que de nouveaux neurones sont ajoutés dans les yeux et le cerveau. Pour déterminer si les axones rétiniens fournissent des informations cruciales pour réguler les comportements des cellules souches tectales et progénitrices tels que la survie, la prolifération et / ou la différenciation, il est nécessaire de pouvoir comparer les lobes tectaux innervés et dénervés chez le même animal et entre les animaux.
L’ablation chirurgicale d’un œil de poisson-zèbre larvaire vivant suivie de l’observation du tectum optique atteint cet objectif. La vidéo d’accompagnement montre comment anesthésier les larves, aiguiser électrolytiquement les aiguilles de tungstène et les utiliser pour enlever un œil. Il montre ensuite comment disséquer les cerveaux des larves de poisson zèbre fixes. Enfin, la vidéo donne un aperçu du protocole d’immunohistochimie et une démonstration de la façon de monter des embryons colorés dans l’agarose à faible point de fusion pour la microscopie.
Introduction
Le but de cette méthode est d’étudier comment l’entrée rétinienne influence la croissance et le développement du tectum optique, le centre de traitement visuel dans le cerveau du poisson-zèbre. En enlevant un œil, puis en comparant les deux côtés du tectum optique, les changements tectaux au sein du même spécimen peuvent être observés et normalisés, ce qui permet une comparaison entre plusieurs spécimens. Les approches moléculaires modernes combinées à cette technique permettront de mieux comprendre les mécanismes sous-jacents à la croissance et au développement du système visuel, ainsi qu’à la dégénérescence et à la régénération axonales.
Les systèmes sensoriels – visuels, auditifs et somatosensoriels – recueillent des informations à partir d’organes externes et transmettent ces informations au système nerveux central, générant des « cartes » du monde extérieur à travers le mésencéphale 1,2. La vision est la modalité sensorielle dominante pour presque tous les vertébrés, y compris de nombreux poissons. La rétine, le tissu neural de l’œil, recueille des informations avec un circuit neuronal composé principalement de photorécepteurs, de cellules bipolaires et de cellules ganglionnaires rétiniennes (CGR), les neurones de projection de la rétine. Les RGC ont de longs axones qui se frayent un chemin à travers la surface interne de la rétine jusqu’à la tête du nerf optique, où ils fasciculent et voyagent ensemble à travers le cerveau, se terminant finalement dans le centre de traitement visuel dans le mésencéphale dorsal. Cette structure est appelée tectum optique chez les poissons et autres vertébrés non mammifères et est homologue au colliculus supérieur chez les mammifères3.
Le tectum optique est une structure multicouche à symétrie bilatérale dans le mésencéphale dorsal. Chez le poisson-zèbre et la plupart des autres poissons, chaque lobe du tectum optique reçoit une entrée visuelle provenant uniquement de l’œil controlatéral, de sorte que le nerf optique gauche se termine dans le lobe tectal droit et le nerf optique droit se termine dans le lobe tectal gauche4 (Figure 1). Comme son homologue mammifère, le colliculus supérieur, le tectum optique intègre l’information visuelle à d’autres entrées sensorielles, y compris l’audition et la somatosensation, contrôlant les changements dans l’attention visuelle et les mouvements oculaires tels que les saccades 1,5,6. Cependant, contrairement au colliculus supérieur des mammifères, le tectum optique génère continuellement de nouveaux neurones et glies à partir d’une niche de cellules souches spécialisée près des bords médial et caudal des lobes tectaux appelée zone de prolifération tectale7. Le maintien des progéniteurs prolifératifs dans le tectum optique et d’autres régions du système nerveux central contribue, en partie, à la remarquable capacité de régénération documentée chez le poisson-zèbre8.
Des travaux antérieurs examinant le cerveau de poissons aveugles ou borgnes ont révélé que la taille du tectum optique est directement proportionnelle à la quantité d’innervation rétinienne qu’il reçoit 9,10,11. Chez les poissons des cavernes adultes, dont les yeux dégénèrent au début de l’embryogenèse, le tectum optique est sensiblement plus petit que celui des poissons de surface observésétroitement apparentés 9. La dégénérescence de l’œil de poisson des cavernes peut être bloquée en remplaçant la lentille endogène par une lentille d’un poisson de surface pendant l’embryogenèse. Lorsque ces poissons des cavernes borgnes sont élevés à l’âge adulte, le lobe tectal innervé contient environ 10% plus de cellules que le lobe tectal non innervé9. De même, chez les larves de killifish qui ont été incubées avec des traitements chimiques pour générer des yeux de différentes tailles au sein d’un même individu, le côté du tectum avec plus d’innervation était plus grand et contenait plus de neurones10. Les preuves provenant d’expériences d’écrasement du nerf optique chez des poissons rouges adultes indiquent que l’innervation favorise la prolifération, la prolifération des cellules tectales diminuant lorsque l’innervation est perturbée11.
Confirmant et étendant ces études classiques, plusieurs rapports récents fournissent des données suggérant que la prolifération en réponse à l’innervation est modulée, au moins en partie, par la voie BDNF-TrkB12,13. De nombreuses questions ouvertes sur la croissance et le développement du tectum optique demeurent, notamment comment un système sensoriel en développement fait face aux blessures et à la dégénérescence axonale, quels signaux cellulaires et moléculaires permettent à l’entrée rétinienne de réguler la croissance du tectum optique, quand ces mécanismes deviennent actifs, et si la prolifération et la différenciation liées à l’innervation permettent à la rétine et à son tissu cible de coordonner les taux de croissance et d’assurer une cartographie rétinotopique précise. En outre, il existe des questions beaucoup plus vastes sur le développement dépendant de l’activité qui peuvent être abordées en interrogeant le système visuel du poisson-zèbre avec des approches chirurgicales telles que celle décrite ci-dessous.
Pour étudier les mécanismes cellulaires et moléculaires par lesquels l’activité neuronale, en particulier à partir de l’entrée visuelle, modifie la survie et la prolifération cellulaires, l’approche décrite compare directement les lobes tectaux innervés et dénervés (Figure 1) chez les larves individuelles de poisson zèbre. Cette méthode permet de documenter la dégénérescence des axones RGC dans le tectum optique et de confirmer que le nombre de cellules mitotiques est en corrélation avec l’innervation.
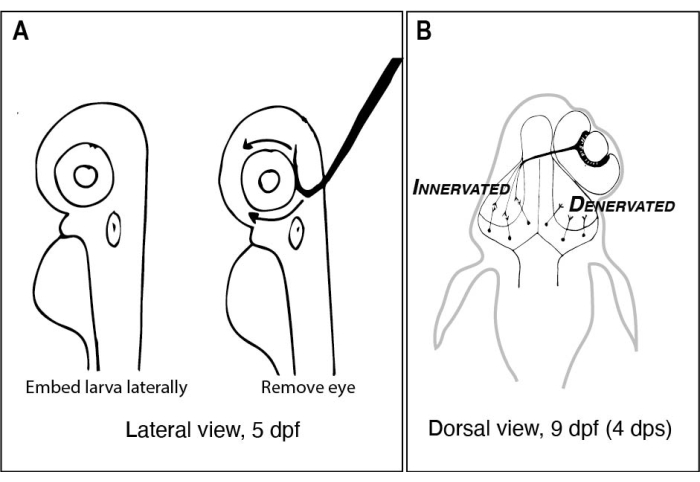
Figure 1: Croquis de larves de poisson zèbre avant et après ablation unilatérale des yeux. (A) Dessin de 5 larves de dpf vues au microscope à dissection. Chaque larve est incrustée dans l’agarose à point de fusion bas et orientée latéralement avant qu’une aiguille en tungstène avec une pointe pointue et crochue ne soit utilisée pour arracher l’œil tourné vers le haut (œil gauche dans cet exemple). (B) Dessin de la vue dorsale d’une larve de 9 dpf résultant de la chirurgie décrite dans A. Seuls trois axones RGC hautement schématisés de l’œil droit sont montrés en train de défasciculer et de se connecter aux neurones du lobe tectal gauche. Abréviations : dpf = jours après la fécondation ; dps = jours après la chirurgie; RGC = cellules ganglionnaires rétiniennes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Les techniques décrites dans cet article illustrent l’une des nombreuses approches pour étudier le développement du système visuel des vertébrés chez le poisson-zèbre. D’autres chercheurs ont publié des méthodes pour disséquer la rétine embryonnaire et effectuer des analyses d’expression génique19 ou visualiser l’activité neuronale dans le tectum optique30. Cet article fournit une approche pour explorer comment l’entrée rétinienne différentielle pe…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Le financement de ce travail a été soutenu principalement par des fonds de démarrage du Reed College à KLC, des fonds de bourses de recherche Helen Stafford à OLH et une bourse de recherche scientifique du Reed College à YK. Ce projet a débuté dans le laboratoire de Steve Wilson en collaboration avec les RH, qui ont été soutenues par une bourse d’études Wellcome Trust (2009-2014). Nous remercions Máté Varga, Steve Wilson et les autres membres du laboratoire Wilson pour les premières discussions sur ce projet, et nous remercions tout particulièrement Florencia Cavodeassi et Kate Edwards, qui ont été les premières à enseigner à KLC comment monter des embryons dans l’agarose et effectuer des dissections cérébrales de poisson-zèbre. Nous remercions également Greta Glover et Jay Ewing pour leur aide dans l’assemblage de notre dispositif d’affûtage d’aiguilles en tungstène.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
References
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

