Øyefjerning i levende sebrafisk larver for å undersøke innervasjonsavhengig vekst og utvikling av det visuelle systemet
Summary
Artikkelen forklarer hvordan man kirurgisk fjerner øyne fra levende sebrafisk larver som det første skrittet mot å undersøke hvordan retinal input påvirker optisk tectum vekst og utvikling. I tillegg gir artikkelen informasjon om larvalbedøvelse, fiksering og hjernespredning, etterfulgt av immunhiistokjemi og konføderasjonsavbildning.
Abstract
Sebrafisk viser bemerkelsesverdig livslang vekst og regenerative evner. For eksempel støtter spesialiserte stamcellenisjer etablert under embryogenese kontinuerlig vekst av hele det visuelle systemet, både i øyet og hjernen. Koordinert vekst mellom netthinnen og det optiske tectum sikrer nøyaktig retinotopisk kartlegging etter hvert som nye nevroner tilsettes i øyne og hjerne. For å adressere om retinal aksoner gir avgjørende informasjon for regulering av tectal stamme og stamcelleoppførsel som overlevelse, spredning og / eller differensiering, er det nødvendig å kunne sammenligne innervated og denervated tectal lobes i samme dyr og på tvers av dyr.
Kirurgisk fjerning av ett øye fra levende larval sebrafisk etterfulgt av observasjon av det optiske tectum oppnår dette målet. Den medfølgende videoen demonstrerer hvordan man bedøver larver, elektrolytisk skjerper wolfram nåler, og bruker dem til å fjerne ett øye. Det neste viser hvordan å dissekere hjerner fra faste sebrafisk larver. Til slutt gir videoen en oversikt over protokollen for immunhistokjemi og en demonstrasjon av hvordan man monterer fargede embryoer i lavsmeltingspunkt agarose for mikroskopi.
Introduction
Målet med denne metoden er å undersøke hvordan retinal input påvirker veksten og utviklingen av det optiske tectum, det visuelle prosesseringssenteret i sebrafiskhjernen. Ved å fjerne ett øye og deretter sammenligne de to sidene av det optiske tectumet, kan tektalendringer i samme prøve observeres og normaliseres, noe som muliggjør sammenligning på tvers av flere prøver. Moderne molekylære tilnærminger kombinert med denne teknikken vil gi innsikt i mekanismene som ligger til grunn for visuell systemvekst og utvikling, samt axonal degenerasjon og regenerering.
Sensoriske systemer – visuelle, auditive og somatosensoriske – samler informasjon fra eksterne organer og videresender den informasjonen til sentralnervesystemet, og genererer “kart” over den ytre verden over midbrain 1,2. Visjon er den dominerende sensoriske modaliteten for nesten alle vertebrater, inkludert mange fisk. Netthinnen, nevralt vev i øyet, samler informasjon med en nevronal krets som hovedsakelig består av fotoreseptorer, bipolare celler og netthinne ganglion celler (RGCs), projeksjon nevroner av netthinnen. RGCer har lange axoner som finner veien over den indre overflaten av netthinnen til synsnerven hodet, hvor de fasciculate og reise sammen gjennom hjernen, til slutt avslutte i visuell behandling senter i dorsal midbrain. Denne strukturen kalles det optiske tectum i fisk og andre ikke-pattedyr vertebrater og er homolog til den overlegne colliculus hos pattedyr3.
Det optiske tectum er en bilateralt symmetrisk flerlagsstruktur i dorsal midbrain. I sebrafisk og de fleste andre fisk mottar hver lobe av det optiske tectum visuelle innspill utelukkende fra det kontralaterale øyet, slik at venstre optisk nerve slutter i høyre tectal lobe og høyre optisk nerve slutter i venstre tectal lobe4 (figur 1). Som sin pattedyr motpart, den overlegne colliculus, integrerer det optiske tectum visuell informasjon med andre sensoriske innganger, inkludert audition og somatosensasjon, kontrollerende skift i visuell oppmerksomhet og øyebevegelser som saccades 1,5,6. Men i motsetning til pattedyrets overlegne colliculus, genererer det optiske tectum kontinuerlig nye nevroner og glia fra en spesialisert stamcellenisje nær de mediale og kaudale kantene på tektal lobes kalt tectal proliferation zone7. Vedlikehold av proliferative forfedre i det optiske tectum og andre regioner i sentralnervesystemet bidrar delvis til den bemerkelsesverdige regenerative kapasiteten dokumentert i sebrafisk8.
Tidligere arbeid med å undersøke hjernen til blinde eller enøyde fisk avslørte at optisk tectumstørrelse er direkte proporsjonal med mengden retinal innervering den mottar 9,10,11. I voksenhulefisk, hvis øyne degener i tidlig embryogenese, er det optiske tectum merkbart mindre enn for nært beslektet, observert overflatefisk9. Cave fish eye degenerasjon kan blokkeres ved å erstatte den endogene linsen med en linse fra en overflatefisk under embryogenese. Når disse enøyde hulefiskene blir oppdrettet til voksen alder, inneholder den innerverte tectal lobe omtrent 10% flere celler enn den ikke-innerverte tectal lobe9. På samme måte, i larval killifish som ble inkubert med kjemiske behandlinger for å generere øyne av forskjellige størrelser i samme individ, var siden av tectum med mer innervasjon større og inneholdt flere nevroner10. Bevis fra optisk nerveknusing eksperimenter i voksen gullfisk indikerer at innervasjon fremmer spredning, med tectal celleproliferasjon avtagende når innervasjon ble forstyrret11.
Ved å bekrefte og utvide disse klassiske studiene, gir flere nylige rapporter data som tyder på at spredning som svar på innervering er modulert, i hvert fall delvis, av BDNF-TrkB-banen12,13. Mange åpne spørsmål om optisk tectum vekst og utvikling gjenstår, inkludert hvordan et utviklende sensorisk system håndterer skade og axon degenerasjon, hvilke cellulære og molekylære signaler som muliggjør retinal input for å regulere optisk tectum vekst, når disse mekanismene blir aktive, og om innervasjon-koblet spredning og differensiering gjør det mulig for netthinnen og målvevet å koordinere vekstrater og sikre nøyaktig retinotopisk kartlegging. I tillegg er det mye større spørsmål om aktivitetsavhengig utvikling som kan løses ved å forhøre sebrafiskens visuelle system med kirurgiske tilnærminger som den som er beskrevet nedenfor.
For å undersøke de cellulære og molekylære mekanismene som nevral aktivitet, spesielt fra visuell inngang, endrer celleoverlevelse og spredning, sammenligner den beskrevne tilnærmingen direkte innerverte og denerverte tektallober (figur 1) innenfor individuelle sebrafisk larver. Denne metoden tillater dokumentasjon av RGC axon degenerasjon i det optiske tectum og bekreftelse på at antall mititotiske celler korrelerer med innervasjon.
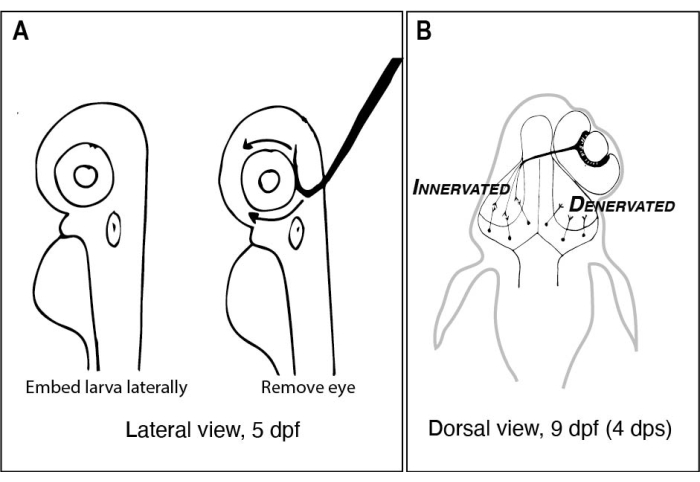
Figur 1: Skisser av sebrafisk larver før og etter ensidig øyefjerning. (A) Tegning av 5 dpf larver sett under et dissekerende mikroskop. Hver larve er innebygd i lavsmeltende punkt agarose og orientert lateralt før en wolfram nål med en skarp, hektet spiss brukes til å øse ut øyet vendt opp (venstre øye i dette eksemplet). (B) Tegning av dorsal utsikt over en 9 dpf larve som følge av operasjonen avbildet i A. Bare tre høyt skjemaerte RGC-axoner fra høyre øye vises defasciculating og tilkobling med nevroner i venstre tectal lobe. Forkortelser: dpf = dager etter befruktning; dps = dager etter operasjonen; RGC = retinal ganglion celler. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Teknikkene beskrevet i denne artikkelen illustrerer en av mange tilnærminger for å studere virveldyr visuell systemutvikling i sebrafisk. Andre forskere har publisert metoder for å dissekere den embryonale netthinnen og utføre genuttrykksanalyser19 eller visualisere nevronaktivitet i det optiske tectum30. Dette dokumentet gir en tilnærming for å utforske hvordan differensial retinal input kan påvirke celleatferd i det optiske tectum.
For ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Støtten til dette arbeidet ble først og fremst støttet av oppstartsmidler fra Reed College til KLC, Helen Stafford Research Fellowship-midler til OLH, og et Reed College Science Research Fellowship til YK. Dette prosjektet begynte i Steve Wilsons laboratorium som et samarbeid med HR, som ble støttet av et Wellcome Trust Studentship (2009-2014). Vi takker Máté Varga, Steve Wilson og andre medlemmer av Wilson-laboratoriet for innledende diskusjoner om dette prosjektet, og vi takker spesielt Florencia Cavodeassi og Kate Edwards, som var de første til å lære KLC hvordan man monterer embryoer i agarose og utfører sebrafisk hjerne disseksjoner. Vi takker også Greta Glover og Jay Ewing for hjelp med montering av vår wolfram nål-slipeenhet.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
References
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

