Ögonborttagning i levande zebrafisklarver för att undersöka innervationsberoende tillväxt och utveckling av det visuella systemet
Summary
Artikeln förklarar hur man kirurgiskt tar bort ögon från levande zebrafisklarver som det första steget mot att undersöka hur retinal inmatning påverkar optisk tektumtillväxt och utveckling. Dessutom ger artikeln information om larvbedövning, fixering och hjärndissektion, följt av immunohistokemi och konfokal avbildning.
Abstract
Zebrafisk uppvisar anmärkningsvärd livslång tillväxt och regenerativa förmågor. Till exempel stöder specialiserade stamcellsnischer som etablerats under embryogenes kontinuerlig tillväxt av hela det visuella systemet, både i ögat och hjärnan. Koordinerad tillväxt mellan näthinnan och det optiska tectum säkerställer noggrann retinotopisk kartläggning när nya neuroner läggs till i ögonen och hjärnan. För att ta itu med huruvida retinala axoner ger avgörande information för att reglera tektala stam- och stamcellsbeteenden som överlevnad, proliferation och / eller differentiering, är det nödvändigt att kunna jämföra innerverade och denerverade tektallober inom samma djur och över djur.
Kirurgiskt avlägsnande av ett öga från levande larvzebrafisk följt av observation av det optiska tectumet uppnår detta mål. Den medföljande videon visar hur man bedövar larver, elektrolytiskt skärper volframnålar och använder dem för att ta bort ett öga. Det visar sedan hur man dissekerar hjärnor från fasta zebrafisklarver. Slutligen ger videon en översikt över protokollet för immunohistokemi och en demonstration av hur man monterar färgade embryon i lågsmältpunktsagaros för mikroskopi.
Introduction
Målet med denna metod är att undersöka hur retinal inmatning påverkar tillväxten och utvecklingen av det optiska tectumet, det visuella bearbetningscentret i zebrafiskhjärnan. Genom att ta bort ett öga och sedan jämföra de två sidorna av det optiska tectumet kan tektala förändringar inom samma prov observeras och normaliseras, vilket möjliggör jämförelse över flera prover. Moderna molekylära tillvägagångssätt i kombination med denna teknik kommer att ge insikter i mekanismerna bakom visuell systemtillväxt och utveckling, liksom axonal degeneration och regenerering.
Sensoriska system – visuella, auditiva och somatosensoriska – samlar in information från yttre organ och vidarebefordrar den informationen till centrala nervsystemet och genererar “kartor” över den yttre världen över mitthjärnen 1,2. Vision är den dominerande sensoriska modaliteten för nästan alla ryggradsdjur, inklusive många fiskar. Näthinnan, den neurala vävnaden i ögat, samlar information med en neuronal krets som huvudsakligen består av fotoreceptorer, bipolära celler och retinala ganglionceller (RGC), näthinnans projektionsneuroner. RGC har långa axoner som hittar sin väg över näthinnans inre yta till synnervshuvudet, där de fascikulaterar och reser tillsammans genom hjärnan och slutligen slutar i det visuella bearbetningscentret i dorsala mitthjärnan. Denna struktur kallas optisk tectum hos fisk och andra icke-däggdjursryggradsdjur och är homolog mot den överlägsna colliculus hos däggdjur3.
Det optiska tectumet är en bilateralt symmetrisk flerskiktad struktur i dorsala mitthjärna. Hos zebrafiskar och de flesta andra fiskar får varje lob i det optiska tektumet visuell inmatning enbart från det kontralaterala ögat, så att vänster synnerv slutar i höger tektallob och höger synnerv slutar i vänster tektallob4 (Figur 1). Liksom sin däggdjurs motsvarighet, den överlägsna colliculus, integrerar det optiska tectum visuell information med andra sensoriska ingångar, inklusive audition och somatosensation, som kontrollerar förändringar i visuell uppmärksamhet och ögonrörelser som saccades 1,5,6. Men till skillnad från däggdjurets överlägsna colliculus genererar det optiska tectum kontinuerligt nya neuroner och glia från en specialiserad stamcellsnisch nära de mediala och kaudala kanterna på tektalloberna som kallas tectal proliferationszon7. Upprätthållande av proliferativa förfäder i det optiska tectumet och andra regioner i centrala nervsystemet bidrar delvis till den anmärkningsvärda regenerativa kapacitet som dokumenteras i zebrafisk8.
Tidigare arbete som undersökte hjärnorna hos blinda eller enögda fiskar avslöjade att optisk tektumstorlek är direkt proportionell mot mängden retinal innervation den får 9,10,11. Hos vuxna grottfiskar, vars ögon degenererar i tidig embryogenes, är det optiska tektumet märkbart mindre än för närstående, synad ytfisk9. Grottfiskögondegeneration kan blockeras genom att ersätta den endogena linsen med en lins från en ytfisk under embryogenesen. När dessa enögda grottfiskar föds upp till vuxen ålder innehåller den innerverade tektalloben cirka 10% fler celler än den icke-innerverade tektalloben9. På samma sätt, i larvdödfisk som inkuberades med kemiska behandlingar för att generera ögon av olika storlekar inom samma individ, var sidan av tectum med mer innervation större och innehöll fler neuroner10. Bevis från optiska nervkrossexperiment hos vuxna guldfiskar indikerar att innervation främjar proliferation, med tektal cellproliferation som minskar när innervation stördes11.
Bekräftar och utvidgar dessa klassiska studier, flera nya rapporter ger data som tyder på att proliferation som svar på innervation moduleras, åtminstone delvis, av BDNF-TrkB-vägen12,13. Många öppna frågor om optisk tektumtillväxt och utveckling kvarstår, inklusive hur ett utvecklande sensoriskt system hanterar skada och axondegenerering, vilka cellulära och molekylära signaler möjliggör retinal ingång för att reglera optisk tektumtillväxt, när dessa mekanismer blir aktiva och om innervationskopplad proliferation och differentiering gör det möjligt för näthinnan och dess målvävnad att samordna tillväxthastigheter och säkerställa korrekt retinotopisk kartläggning. Dessutom finns det mycket större frågor om aktivitetsberoende utveckling som kan hanteras genom att förhöra zebrafiskens visuella system med kirurgiska tillvägagångssätt som den som beskrivs nedan.
För att undersöka de cellulära och molekylära mekanismer genom vilka neural aktivitet, specifikt från visuell inmatning, förändrar cellöverlevnad och proliferation, jämför det beskrivna tillvägagångssättet direkt innerverade och denerverade tektallober (Figur 1) inom enskilda zebrafisklarver. Denna metod möjliggör dokumentation av RGC-axondegenerering i det optiska tektumet och bekräftelse på att antalet mitotiska celler korrelerar med innervation.
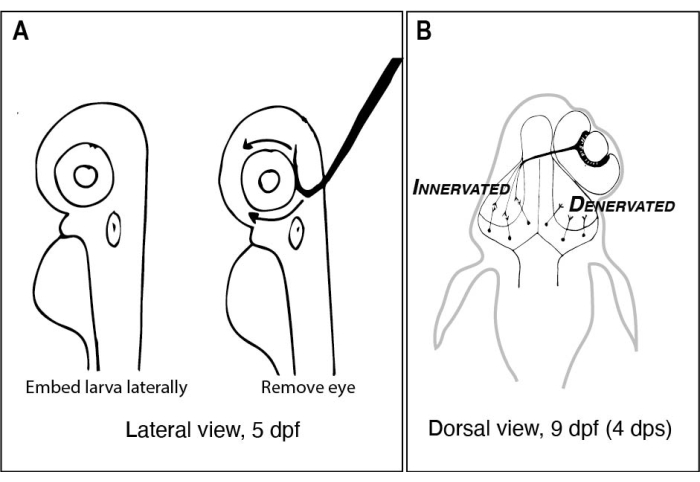
Figur 1: Skisser av zebrafisklarver före och efter ensidig ögonborttagning. (A) Ritning av 5 dpf larver sett under ett dissekerande mikroskop. Varje larv är inbäddad i lågsmältpunkt agaros och orienterad i sidled innan en volframnål med en skarp, krokad spets används för att skopa ut ögat uppåt (vänster öga i detta exempel). (B) Ritning av den dorsala vyn av en 9 dpf larv som härrör från den operation som avbildas i A. Endast tre mycket schematiserade RGC-axoner från höger öga visas defascikulerande och anslutande med neuroner i vänster tektallob. Förkortningar: dpf = dagar efter befruktning; dps = dagar efter operationen; RGC = retinala ganglionceller. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
De tekniker som beskrivs i denna uppsats illustrerar en av många metoder för att studera ryggradsdjurs visuella systemutveckling hos zebrafiskar. Andra forskare har publicerat metoder för att dissekera den embryonala näthinnan och utföra genuttrycksanalyser19 eller visualisera neuronal aktivitet i det optiska tectum30. Detta dokument ger ett tillvägagångssätt för att utforska hur differentiell retinal inmatning kan påverka cellbeteenden i det optiska tectumet.
…Divulgations
The authors have nothing to disclose.
Acknowledgements
Finansiering för detta arbete stöddes främst av startfonder från Reed College till KLC, Helen Stafford Research Fellowship-medel till OLH och ett Reed College Science Research Fellowship till YK. Detta projekt började i Steve Wilsons labb som ett samarbete med HR, som stöddes av ett Wellcome Trust Studentship (2009-2014). Vi tackar Máté Varga, Steve Wilson och andra medlemmar av Wilson-laboratoriet för inledande diskussioner om detta projekt, och vi tackar särskilt Florencia Cavodeassi och Kate Edwards, som var de första som lärde KLC hur man monterar embryon i agaros och utför zebrafiskhjärndissektioner. Vi tackar också Greta Glover och Jay Ewing för hjälp med att montera vår volframnålslipningsenhet.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
References
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

