Görsel Sistemin Innervasyona Bağlı Büyümesini ve Gelişimini İncelemek için Canlı Zebra Balığı Larvalarında Göz Çıkarılması
Summary
Makale, retinal girdinin optik tektum büyümesini ve gelişimini nasıl etkilediğini araştırmaya yönelik ilk adım olarak canlı zebra balığı larvalarından gözlerin cerrahi olarak nasıl çıkarılacağını açıklamaktadır. Ek olarak, makale larva anesteziizasyonu, fiksasyon ve beyin diseksiyonu, ardından immünohistokimya ve konfokal görüntüleme hakkında bilgi vermektedir.
Abstract
Zebra balığı, yaşam boyu olağanüstü büyüme ve rejeneratif yetenekler sergiler. Örneğin, embriyogenez sırasında kurulan özel kök hücre nişleri, hem gözde hem de beyinde tüm görsel sistemin sürekli büyümesini destekler. Retina ve optik tektum arasındaki koordineli büyüme, gözlere ve beyne yeni nöronlar eklendikçe doğru retinotopik haritalamayı sağlar. Retinal aksonların hayatta kalma, proliferasyon ve / veya farklılaşma gibi tektal kök ve progenitör hücre davranışlarını düzenlemek için önemli bilgiler sağlayıp sağlamadığını ele almak için, aynı hayvan içindeki ve hayvanlar arasındaki innerve ve denervated tektal lobları karşılaştırabilmek gerekir.
Canlı larva zebra balığından bir gözün cerrahi olarak çıkarılması ve ardından optik tektumun gözlemlenmesi bu amaca ulaşır. Eşlik eden video, larvaların nasıl anestezi altına alınacağını, tungsten iğnelerinin elektrolitik olarak keskinleştirileceğini ve bir gözü çıkarmak için nasıl kullanılacağını göstermektedir. Daha sonra beyinlerin sabit zebra balığı larvalarından nasıl disseke edileceğini gösterir. Son olarak, video immünohistokimya protokolüne genel bir bakış ve mikroskopi için düşük erime noktalı agarozda boyalı embriyoların nasıl monte edileceğine dair bir gösteri sunmaktadır.
Introduction
Bu yöntemin amacı, retinal girdinin zebra balığı beynindeki görsel işlem merkezi olan optik tektumun büyümesini ve gelişimini nasıl etkilediğini araştırmaktır. Bir gözün çıkarılması ve ardından optik tektumun iki tarafının karşılaştırılmasıyla, aynı numunedeki tektal değişiklikler gözlemlenebilir ve normalleştirilebilir, böylece birden fazla örnek arasında karşılaştırma yapılabilir. Bu teknikle birleştirilen modern moleküler yaklaşımlar, görsel sistem büyümesi ve gelişiminin altında yatan mekanizmaların yanı sıra aksonal dejenerasyon ve rejenerasyon hakkında fikir verecektir.
Duyusal sistemler – görsel, işitsel ve somatosensoriyel – dış organlardan bilgi toplar ve bu bilgiyi merkezi sinir sistemine iletir, orta beyindeki dış dünyanın “haritalarını” oluşturur 1,2. Görme, birçok balık da dahil olmak üzere neredeyse tüm omurgalılar için baskın duyusal modalitedir. Gözdeki nöral doku olan retina, öncelikle retinanın projeksiyon nöronları olan fotoreseptörler, bipolar hücreler ve retinal ganglion hücrelerinden (RGC’ler) oluşan nöronal bir devre ile bilgi toplar. RGC’ler, retinanın iç yüzeyinden optik sinir kafasına giden yolu bulan uzun aksonlara sahiptir, burada beyinde büyülenir ve birlikte hareket ederler, sonuçta dorsal orta beyindeki görsel işlem merkezinde sona ererler. Bu yapıya balıklarda ve diğer memeli olmayan omurgalılarda optik tektum denir ve memelilerdeki üstün kollikulusa homologdur3.
Optik tektum, dorsal orta beyinde bilateral simetrik çok katmanlı bir yapıdır. Zebra balıklarında ve diğer balıkların çoğunda, optik tektumun her bir lobu yalnızca kontralateral gözden görsel girdi alır, böylece sol optik sinir sağ tektal lobda sona erer ve sağ optik sinir sol tektallobda sona erer 4 (Şekil 1). Memeli meslektaşı olan üstün kollikulus gibi, optik tektum da görsel bilgiyi seçmeler ve somatosensation dahil olmak üzere diğer duyusal girdilerle bütünleştirir, görsel dikkatteki kaymaları ve sakkadlar 1,5,6 gibi göz hareketlerini kontrol eder. Bununla birlikte, memeli superior kollikulusundan farklı olarak, optik tektum, tektal proliferasyon bölgesi7 olarak adlandırılan tektal lobların medial ve kaudal kenarlarının yakınındaki özel bir kök hücre nişinden sürekli olarak yeni nöronlar ve glia üretir. Optik tektumda ve merkezi sinir sisteminin diğer bölgelerinde proliferatif progenitörlerin bakımı, kısmen, zebra balığı8’de belgelenen olağanüstü rejeneratif kapasiteye katkıda bulunur.
Kör veya tek gözlü balıkların beyinlerini inceleyen önceki çalışmalar, optik tektum büyüklüğünün aldığı retinal innervasyon miktarıile doğru orantılı olduğunu ortaya koymuştur 9,10,11. Gözleri erken embriyogenezde dejenere olan yetişkin mağara balıklarında, optik tektum, yakından ilişkili, gören yüzey balıklarından belirgin şekilde daha küçüktür9. Mağara balık gözü dejenerasyonu, embriyogenez sırasında endojen lensin yüzey balığından bir mercekle değiştirilmesiyle engellenebilir. Bu tek gözlü mağara balıkları yetişkinliğe yetiştirildiğinde, innerve tektal lob, innerve edilmemiş tektal lobdan yaklaşık% 10 daha fazla hücre içerir9. Benzer şekilde, aynı birey içinde farklı boyutlarda gözler üretmek için kimyasal işlemlerle inkübe edilen larva killifish’te, tektumun daha fazla innervasyona sahip tarafı daha büyüktü ve daha fazla nöron içeriyordu10. Yetişkin akvaryum balıklarında optik sinir ezme deneylerinden elde edilen kanıtlar, innervasyonun proliferasyonu desteklediğini, innervasyon bozulduğunda tektal hücre proliferasyonunun azaldığını göstermektedir11.
Bu klasik çalışmaları doğrulayan ve genişleten birkaç yeni rapor, innervasyona yanıt olarak proliferasyonun, en azından kısmen, BDNF-TrkB yolu12,13 tarafından modüle edildiğini gösteren veriler sunmaktadır. Gelişmekte olan bir duyusal sistemin yaralanma ve akson dejenerasyonu ile nasıl başa çıktığı, hangi hücresel ve moleküler sinyallerin retina girişinin optik tektum büyümesini düzenlemesini sağladığı, bu mekanizmaların ne zaman aktif hale geldiği ve innervasyona bağlı proliferasyon ve farklılaşmanın retina ve hedef dokusunun büyüme oranlarını koordine etmesini ve doğru retinotopik haritalamayı sağlamasını sağlayıp sağlamadığı da dahil olmak üzere optik tektum büyümesi ve gelişimi hakkında birçok açık soru devam etmektedir. Ek olarak, zebra balığı görsel sistemini aşağıda tarif edilenler gibi cerrahi yaklaşımlarla sorgulayarak ele alınabilecek aktiviteye bağlı gelişim hakkında çok daha büyük sorular vardır.
Nöral aktivitenin, özellikle görsel girdiden, hücre sağkalımını ve proliferasyonunu değiştirdiği hücresel ve moleküler mekanizmaları araştırmak için, tarif edilen yaklaşım, bireysel zebra balığı larvaları içindeki innerve ve denervated tektal lobları (Şekil 1) doğrudan karşılaştırmaktadır. Bu yöntem, optik tektumdaki RGC akson dejenerasyonunun belgelenmesine ve mitotik hücrelerin sayısının innervasyon ile ilişkili olduğunun doğrulanmasına izin verir.
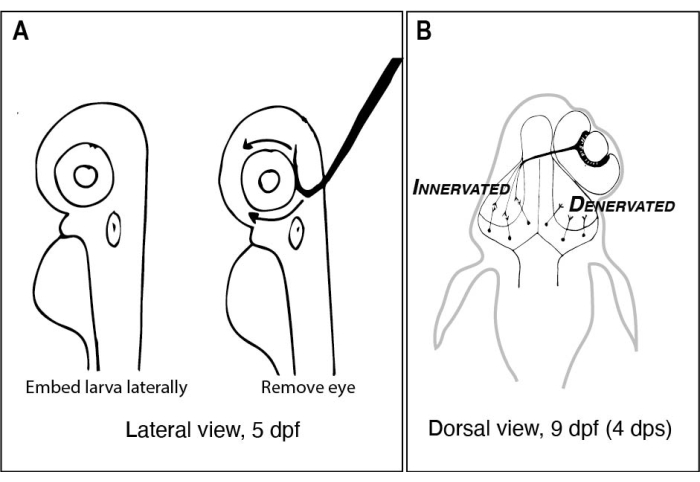
Şekil 1: Zebra balığı larvalarının tek taraflı göz çıkarılmasından önce ve sonra çizikleri . (A) Diseksiyon mikroskobu altında görüldüğü gibi 5 dpf larvasının çizimi. Her larva, düşük erime noktalı agaroza gömülür ve gözü yukarı bakacak şekilde çıkarmak için keskin, kancalı bir ucu olan bir tungsten iğnesi kullanılmadan önce yanal olarak yönlendirilir (bu örnekte sol göz). (B) A’da tasvir edilen ameliyattan kaynaklanan 9 dpf larvanın dorsal görünümünün çizilmesi. Sağ gözden sadece üç yüksek şematize RGC aksonunun defasciculating olduğu ve sol tektal lobdaki nöronlarla bağlandığı gösterilmiştir. Kısaltmalar: dpf = döllenmeden sonraki günler; dps = ameliyat sonrası günler; RGC = retinal ganglion hücreleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu makalede açıklanan teknikler, zebra balıklarında omurgalı görsel sistem gelişimini incelemek için birçok yaklaşımdan birini göstermektedir. Diğer araştırmacılar, embriyonik retinayı incelemek ve gen ekspresyon analizleri yapmak için yöntemler yayınladılar19 veya optik tektum30’daki nöronal aktiviteyi görselleştirdiler. Bu makale, diferansiyel retinal girdinin optik tektumdaki hücre davranışlarını nasıl etkileyebileceğini araştırmak için …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu çalışmanın finansmanı öncelikle Reed College’dan KLC’ye, Helen Stafford Research Fellowship fonlarından OLH’ye ve Reed College Science Research Fellowship’ten YK’ya başlangıç fonları ile desteklendi. Bu proje, Steve Wilson’ın laboratuvarında, Wellcome Trust Studentship (2009-2014) tarafından desteklenen İK ile işbirliği içinde başladı. Máté Varga, Steve Wilson ve Wilson laboratuvarının diğer üyelerine bu proje hakkındaki ilk tartışmalar için teşekkür ediyoruz ve özellikle KLC’ye agarozda embriyoların nasıl monte edileceğini ve zebra balığı beyin diseksiyonlarının nasıl yapılacağını öğreten ilk Florencia Cavodeassi ve Kate Edwards’a teşekkür ediyoruz. Ayrıca Greta Glover ve Jay Ewing’e tungsten iğne bileme cihazımızın montajında yardımcı oldukları için teşekkür ederiz.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
References
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

