Réalisation de myographie d’impédance électrique in vivo et ex vivo chez les rongeurs
Summary
Cet article explique comment effectuer une myographie d’impédance électrique in vivo (à l’aide de réseaux d’électrodes de surface et à aiguilles) et ex vivo (à l’aide d’une cellule diélectrique) sur le muscle gastrocnémien du rongeur. Il démontrera la technique chez les souris et les rats et détaillera les modifications disponibles (c.-à-d. animaux obèses, petits).
Abstract
La myographie d’impédance électrique (MIE) est une technique pratique qui peut être utilisée dans les études précliniques et cliniques pour évaluer la santé et la maladie des tissus musculaires. L’EIM est obtenue en appliquant un courant électrique de faible intensité, focalisé directionnellement, à un muscle d’intérêt sur une gamme de fréquences (c.-à-d. de 1 kHz à 10 MHz) et en enregistrant les tensions résultantes. À partir de ceux-ci, plusieurs composants d’impédance standard, y compris la réactance, la résistance et la phase, sont obtenus. Lors de la réalisation de mesures ex vivo sur un muscle excisé, les propriétés électriques passives inhérentes du tissu, à savoir la conductivité et la permittivité relative, peuvent également être calculées. L’EIM a été largement utilisée chez les animaux et les humains pour diagnostiquer et suivre les altérations musculaires dans diverses maladies, en relation avec une simple atrophie de désuétude, ou comme mesure d’intervention thérapeutique. Sur le plan clinique, l’EIM offre la possibilité de suivre la progression de la maladie au fil du temps et d’évaluer l’impact des interventions thérapeutiques, offrant ainsi la possibilité de raccourcir la durée des essais cliniques et de réduire les exigences relatives à la taille des échantillons. Parce qu’il peut être réalisé de manière non invasive ou peu invasive dans des modèles animaux vivants ainsi que chez l’homme, EIM offre le potentiel de servir de nouvel outil translationnel permettant à la fois le développement préclinique et clinique. Cet article fournit des instructions étape par étape sur la façon d’effectuer des mesures EIM in vivo et ex vivo chez la souris et le rat, y compris des approches pour adapter les techniques à des conditions spécifiques, telles que l’utilisation chez les chiots ou les animaux obèses.
Introduction
La myographie d’impédance électrique (MIE) fournit une méthode puissante pour évaluer l’état musculaire, permettant potentiellement le diagnostic des troubles neuromusculaires, le suivi de la progression de la maladie et l’évaluation de la réponse au traitement 1,2,3. Il peut être appliqué de manière analogue aux modèles de maladies animales et aux humains, ce qui permet une traduction relativement transparente des études précliniques aux études cliniques. Les mesures EIM sont facilement obtenues à l’aide de quatre électrodes placées linéairement, les deux électrodes externes appliquant un courant électrique faible et indolore sur une gamme de fréquences (généralement entre 1 kHz et environ 2 MHz), et les deux électrodes internes enregistrant les tensions résultantes1. À partir de ces tensions, les caractéristiques d’impédance du tissu peuvent être obtenues, y compris la résistance (R), une mesure de la difficulté pour le courant de traverser le tissu, et la réactance (X) ou « chargeabilité » du tissu, une mesure liée à la capacité du tissu à stocker la charge (capacité). À partir de la réactance et de la résistance, l’angle de phase (θ) est calculé via l’équation suivante: 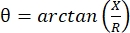 , fournissant une seule mesure d’impédance sommative. De telles mesures peuvent être obtenues à l’aide de n’importe quel dispositif de bioimpédance multifréquence. Comme les myofibres sont essentiellement de longs cylindres, le tissu musculaire est également très anisotrope, le courant circulant plus facilement le long des fibres qu’à travers elles 4,5. Ainsi, l’EIM est souvent effectuée dans deux directions: avec le réseau placé le long des fibres de telle sorte que le courant leur soit parallèle, et à travers le muscle de telle sorte que le courant circule perpendiculairement à elles. De plus, dans les mesures ex vivo, où un volume connu de tissu est mesuré dans une cellule de mesure d’impédance, les propriétés électriques inhérentes du muscle (c’est-à-dire la conductivité et la permittivité relative) peuvent être déduites6.
, fournissant une seule mesure d’impédance sommative. De telles mesures peuvent être obtenues à l’aide de n’importe quel dispositif de bioimpédance multifréquence. Comme les myofibres sont essentiellement de longs cylindres, le tissu musculaire est également très anisotrope, le courant circulant plus facilement le long des fibres qu’à travers elles 4,5. Ainsi, l’EIM est souvent effectuée dans deux directions: avec le réseau placé le long des fibres de telle sorte que le courant leur soit parallèle, et à travers le muscle de telle sorte que le courant circule perpendiculairement à elles. De plus, dans les mesures ex vivo, où un volume connu de tissu est mesuré dans une cellule de mesure d’impédance, les propriétés électriques inhérentes du muscle (c’est-à-dire la conductivité et la permittivité relative) peuvent être déduites6.
Le terme « troubles neuromusculaires » définit un large éventail de maladies primaires et secondaires qui entraînent une altération et un dysfonctionnement musculaire structurel. Cela comprend la sclérose latérale amyotrophique et diverses formes de dystrophie musculaire, ainsi que des changements plus simples liés au vieillissement (p. ex. sarcopénie), à l’atrophie de la désuétude (p. ex. en raison d’un alitement prolongé ou de la microgravité) ou même à une blessure7. Bien que les causes soient nombreuses et puissent provenir du motoneurone, des nerfs, des jonctions neuromusculaires ou du muscle lui-même, l’EIM peut être utilisée pour détecter les altérations précoces du muscle dues à bon nombre de ces processus et pour suivre la progression ou la réponse au traitement. Par exemple, chez les patients atteints de dystrophie musculaire de Duchenne (DMD), il a été démontré que l’EIM détecte la progression de la maladie et la réponse aux corticostéroïdes8. Des travaux récents ont également montré que l’EIM est sensible à divers états de désuétude, y compris la gravité fractionnée9, comme ce serait le cas sur la Lune ou Mars, et les effets du vieillissement10,11. Enfin, en appliquant des algorithmes prédictifs et d’apprentissage automatique à l’ensemble de données obtenues à chaque mesure (données multifréquences et directionnellement dépendantes), il devient possible de déduire les aspects histologiques du tissu, y compris la taille des myofibres 12,13, les changements inflammatoires et l’œdème 14, et la teneur en tissu conjonctif et en graisse 15,16.
Plusieurs autres méthodes non invasives ou mini-invasives sont également utilisées pour évaluer la santé musculaire chez les humains et les animaux, y compris l’électromyographie à l’aiguille17 et les technologies d’imagerie telles que l’imagerie par résonance magnétique, la tomographie informatisée et l’échographie18,19. Cependant, EIM présente des avantages distincts par rapport à ces technologies. Par exemple, l’électromyographie enregistre uniquement les propriétés électriques actives des membranes myofibreuses et non les propriétés passives, et ne peut donc pas fournir une véritable évaluation de la composition ou de la structure musculaire. À certains égards, les méthodes d’imagerie sont plus étroitement liées à l’EIM, car elles fournissent également des informations sur la structure et la composition des tissus. Mais dans un certain sens, ils fournissent trop de données, nécessitant une segmentation détaillée des images et une analyse d’experts plutôt que de simplement fournir une sortie quantitative. De plus, compte tenu de leur complexité, les techniques d’imagerie sont également grandement influencées par les spécificités du matériel et des logiciels utilisés, ce qui nécessite idéalement l’utilisation de systèmes identiques afin que les ensembles de données puissent être comparés. En revanche, le fait que l’EIM soit beaucoup plus simple signifie qu’il est moins impacté par ces problèmes techniques et ne nécessite aucune forme de traitement d’image ou d’expertise.
Le protocole suivant montre comment effectuer une EIM de vivo chez le rat et la souris, en utilisant à la fois des techniques non invasives (réseau de surface) et mini-invasives (réseau d’aiguilles sous-cutanées), ainsi que des EIM ex vivo sur des muscles fraîchement excisés.
Protocol
Representative Results
Discussion
Cet article fournit les méthodes de base pour effectuer l’EIM chez les rongeurs, à la fois de vivo et ex vivo. Pour acquérir des mesures fiables, il est essentiel d’effectuer une série d’étapes. Tout d’abord, il faut bien identifier le muscle d’intérêt, car chaque muscle aura des réponses différentes aux maladies, au traitement et à la pathologie. Il faut garder à l’esprit que les données acquises sur un muscle (par exemple, gastrocnémien) ne fourniront pas les mêmes informatio…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par Charley’s Fund et NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
References
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

