Techniques de microscopie pour interpréter la colonisation fongique dans les tissus végétaux mycohétérotrophes et germination symbiotique des graines
Summary
Ce protocole vise à fournir des procédures détaillées pour la collecte, la fixation et la conservation d’échantillons de plantes mycohétérotrophes, en appliquant différentes techniques de microscopie telles que la microscopie électronique à balayage et à transmission, la microscopie optique, confocale et à fluorescence pour étudier la colonisation fongique dans les tissus et les graines des plantes germées avec des champignons mycorhiziens.
Abstract
La botanique structurale est une perspective indispensable pour bien comprendre l’écologie, la physiologie, le développement et l’évolution des plantes. Lors de la recherche sur les plantes mycohétérotrophes (c’est-à-dire les plantes qui obtiennent du carbone des champignons), des aspects remarquables de leurs adaptations structurelles, les modèles de colonisation des tissus par les champignons et la morphoanatomie des organes souterrains peuvent éclairer leurs stratégies de développement et leurs relations avec les hyphes, la source de nutriments. Un autre rôle important des champignons symbiotiques est lié à la germination des graines d’orchidées; toutes les espèces d’Orchidaceae sont mycohétérotrophes pendant la germination et le stade des plantules (mycohétérotrophie initiale), même celles qui photosynthétisent à l’âge adulte. En raison du manque de réserves nutritionnelles dans les graines d’orchidées, les symbiotes fongiques sont essentiels pour fournir des substrats et permettre la germination. L’analyse des stades de germination par perspective structurelle peut également répondre à des questions importantes concernant l’interaction des champignons avec les graines. Différentes techniques d’imagerie peuvent être appliquées pour dévoiler des champignons endophytes dans les tissus végétaux, comme le proposent cet article. Des sections à main levée et minces d’organes végétaux peuvent être colorées puis observées à l’aide de la microscopie optique. Un fluorochrome conjugué à l’agglutinine de germe de blé peut être appliqué sur les champignons et co-incubé avec Calcofluor White pour mettre en évidence les parois cellulaires végétales en microscopie confocale. En outre, les méthodologies de microscopie électronique à balayage et à transmission sont détaillées pour les orchidées mycohétérotrophes, et les possibilités d’appliquer de tels protocoles dans des plantes apparentées sont explorées. La germination symbiotique des graines d’orchidées (c’est-à-dire en présence de champignons mycorhiziens) est décrite en détail dans le protocole, ainsi que les possibilités de préparer les structures obtenues à partir de différentes étapes de la germination pour des analyses par microscopie optique, confocale et électronique.
Introduction
La recherche structurale en botanique, couvrant la morphologie et l’anatomie des plantes, est fondamentale pour comprendre l’organisme entier1,2, et fournit des perspectives indispensables pour intégrer et contribuer à la connaissance de l’écologie, de la physiologie, du développement et de l’évolution des plantes3. Les méthodes en morphologie et anatomie des plantes comprennent actuellement des protocoles, des équipements et des connaissances développés récemment ainsi qu’il y a plus d’un siècle2. L’exécution et l’adaptation continues de méthodes classiques (par exemple, la microscopie optique) ainsi que des techniques plus récentes (par exemple, la microscopie confocale, la microtomographie à rayons X) ont la même base essentielle: des connaissances théoriques permettant le développement d’une méthodologie.
L’outil principal en anatomie et morphologie des plantes est l’image. Malgré l’idée fausse que de telles analyses sont de simples observations, laissant place aux interprétations subjectives2, l’analyse et la compréhension des images dans ce domaine nécessitent une connaissance des méthodes appliquées (équipement, type d’analyse, procédures méthodologiques), des composants cellulaires, de l’histochimie et du corps végétal (organisation et fonction tissulaire, ontogenèse, adaptations morphologiques). L’interprétation des images obtenues par diverses méthodes peut conduire à corréler la forme et la fonction, à déchiffrer la composition chimique d’une structure, à corroborer la description des taxons, à comprendre les infections par les phytopathogènes et à d’autres évaluations similaires.
Lors de la recherche sur les plantes mycohétérotrophes (MH) (c’est-à-dire les plantes non photosynthétiques qui obtiennent du carbone à partir de champignons mycorhiziens4,5), des aspects remarquables de leurs adaptations structurelles, les modèles de colonisation des tissus par les champignons et la morphoanatomie des organes souterrains peuvent éclairer leurs stratégies de développement et leurs relations avec les hyphes, qui sont la source de nutriments. Les organes souterrains des plantes MH présentent généralement des adaptations importantes liées à leur association avec les champignons du sol, il est donc essentiel d’effectuer ces investigations anatomiques et morphologiques6. Les organes aériens des espèces MH ne doivent pas être ignorés, car les endophytes peuvent également être présents dans ces tissus, même s’ils ne sont pas des champignons mycorhiziens (observations personnelles, pas encore publiées).
Outre l’essentialité bien établie de l’association des champignons mycorhiziens avec les espèces MH tout au long de leur cycle de vie7, toutes les espèces d’orchidées, même les autotrophes, ont un stade mycohétérotrophe obligatoire initial dans les milieux naturels. Elle se produit parce que l’embryon des orchidées est indifférencié et dépourvu d’endosperme ou de cotylédons, étant donc incapable de se développer et de s’établir dans des environnements naturels sans le soutien nutritionnel de partenaires fongiques 4,8. Considérant que, les protocoles de germination symbiotique peuvent être appliqués non seulement aux espèces MH, mais aussi aux orchidées photosynthétiques, visant à étudier la spécificité orchidée-champignon dans la germination et le développement du protocorme, une méthodologie largement appliquée dans les initiatives de conservation des espèces menacées 9,10,11.
Dans cet assemblage de méthodes, nous décrivons les étapes importantes impliquées dans la collecte, la fixation et le stockage d’échantillons de plantes MH pour les études anatomiques (section 1), l’analyse de surface et la sélection des échantillons (section 2), les méthodes de sectionnement (à main levée: section 3, microtomie: section 4, cryomicrotomie: section 5), coloration et montage (section 6), la fluorescence et la microscopie confocale des endophytes fongiques (section 7), la microscopie électronique à balayage (section 8), et la microscopie électronique à transmission (section 9). De plus, nous décrivons une méthode de germination symbiotique pour les graines d’orchidées (MH et autotrophe, section 10), car les méthodes d’imagerie mentionnées précédemment peuvent être appliquées avec succès pour analyser la colonisation fongique des graines, des protocormes et des plantules dans le processus de germination.
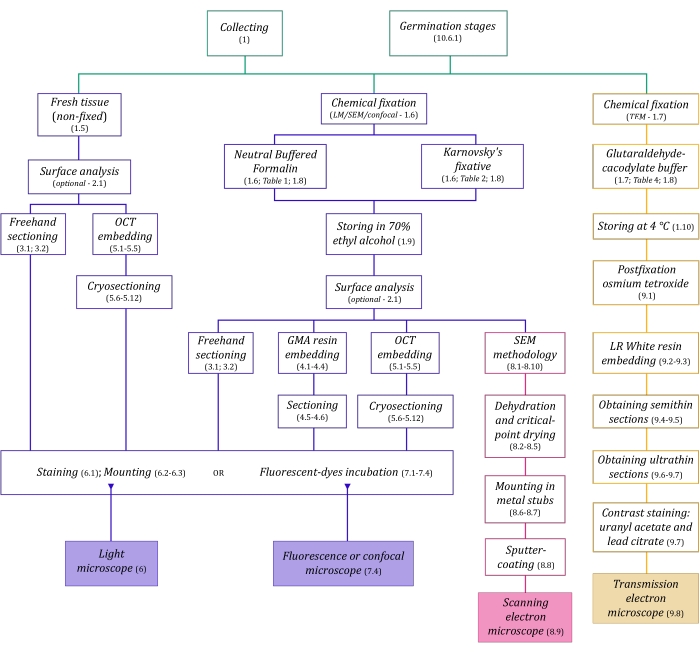
Figure 1 : Résumé schématique des méthodes d’imagerie. Les schémas fournissent des indications sur les étapes du protocole dans lesquelles ils sont détaillés. Abréviations : GMA = méthacrylate de glycol, OCT = composé à température de coupe optimale, MEB = microscopie électronique à balayage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les techniques de microscopie décrites ici en détail (Figure 1) sont précédées des étapes essentielles suivantes : prélèvement, fixation, déshydratation, enrobage et sectionnement des échantillons. Comme les étapes sont variables (figure 1) en fonction de la ou des techniques choisies, il est important de penser à l’avenir, en tenant compte des fixateurs à préparer et à transporter vers le site de prélèvement, de la façon dont les échantillons doivent être préparés avant la fixation, des processus de déshydratation à utiliser (section 1), des différentes possibilités d’encastrement et des méthodes de sectionnement (sections 4, 5, et 9). La figure 1 résume séquentiellement toutes les étapes requises pour chaque technique de microscopie décrite en détail ci-dessous.
Protocol
Representative Results
Discussion
Les analyses d’images en anatomie et morphologie des plantes ont un potentiel important pour atteindre les objectifs et aider à comprendre les relations entre les plantes mycohétérotrophes et leurs endophytes fongiques indispensables, comme le démontrent les études sur les organes souterrains6,40, les analyses structurelles de la germination symbiotique des graines39 et les structures aériennes et reproductrices 41<sup class="xref"…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Les auteurs remercient le financement de FAEPEX et FAPESP (2015/26479-6). MPP remercie Capes pour sa bourse de maîtrise (processus 88887.600591/2021-00) et CNPq. JLSM remercie CNPq pour les subventions de productivité (303664/2020-7). Les auteurs remercient également l’accès aux équipements et à l’assistance fournis par le LME (Laboratoire de Microscopie Electronique – IB/Unicamp), l’INFABiC (Institut National des Sciences et Technologies de la Photonique Appliquée à la Biologie Cellulaire – Unicamp) et le LaBiVasc (Laboratoire de Biologie Vasculaire – DBEF/IB/Unicamp) ; LAMEB (UFSC) et Eliana de Medeiros Oliveira (UFSC) pour leurs contributions au protocole de cryoprotection ; LME pour les contributions au protocole TEM.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

