Beregningsmodellering af retinale neuroner til visuel proteseforskning - grundlæggende tilgange
Summary
Vi opsummerer en arbejdsgang til beregningsmæssigt at modellere en retinal neurons adfærd som reaktion på elektrisk stimulering. Beregningsmodellen er alsidig og omfatter automatiseringstrin, der er nyttige til at simulere en række fysiologiske scenarier og foregribe resultaterne af fremtidige in vivo / in vitro-undersøgelser .
Abstract
Computational modellering er blevet en stadig vigtigere metode inden for neural engineering på grund af dens evne til at forudsige adfærd i in vivo og in vitro systemer. Dette har den vigtigste fordel at minimere antallet af dyr, der kræves i en given undersøgelse ved at give en ofte meget præcis forudsigelse af fysiologiske resultater. Inden for visuel protese har beregningsmodellering en række praktiske anvendelser, herunder information om design af et implanterbart elektrodeararray og forudsigelse af visuelle opfattelser, der kan fremkaldes gennem levering af elektriske impulser fra det nævnte array. Nogle modeller beskrevet i litteraturen kombinerer en tredimensionel (3D) morfologi til beregning af det elektriske felt og en kabelmodel af neuronen eller neurale netværk af interesse. For at øge tilgængeligheden af denne totrinsmetode for forskere, der kan have begrænset tidligere erfaring med beregningsmodellering, leverer vi en video af de grundlæggende tilgange, der skal tages for at konstruere en beregningsmodel og bruge den til at forudsige de fysiologiske og psykofysiske resultater af stimuleringsprotokoller, der anvendes via en visuel protese. Vejledningen omfatter trinene til at opbygge en 3D-model i en FEM-software (finite element modeling), konstruktionen af en retinal ganglioncellemodel i en multi-compartmental neuron beregningssoftware, efterfulgt af sammenlægning af de to. En finite element modellering software til numerisk løsning af fysiske ligninger ville blive brugt til at løse elektrisk feltfordeling i vævets elektriske stimuleringer. Derefter blev specialiseret software til simulering af de elektriske aktiviteter i en neural celle eller et netværk brugt. For at følge denne vejledning kræves kendskab til arbejdsprincippet for en neuroprostese samt neurofysiologiske begreber (f.eks. Handlingspotentialemekanisme og en forståelse af Hodgkin-Huxley-modellen).
Introduction
Visuelle neuroprosteser er en gruppe enheder, der leverer stimuleringer (elektrisk, lys osv.) til de neurale celler i den visuelle vej for at skabe fosfener eller fornemmelse af at se lyset. Det er en behandlingsstrategi, der har været i klinisk brug i næsten et årti for mennesker med permanent blindhed forårsaget af degenerative retinale sygdomme. Typisk vil et komplet system omfatte et eksternt kamera, der fanger den visuelle information omkring brugeren, en strømforsyning og computerenhed til at behandle og oversætte billedet til en række elektriske impulser og et implanteret elektrodearray, der grænseflader det neurale væv og leverer de elektriske impulser til neurale celler. Arbejdsprincippet gør det muligt at placere en visuel neuroprotese på forskellige steder langs den visuelle vej fra nethinden til den visuelle cortex, så længe den er nedstrøms fra det beskadigede væv. Et flertal af den nuværende forskning i visuelle neuroproteser fokuserer på at øge effektiviteten af stimuleringen og forbedre den rumlige skarphed for at give en mere naturlig vision.
I bestræbelserne på at forbedre effektiviteten af stimuleringen har beregningsmodellering været en omkostnings- og tidseffektiv metode til at validere et protesedesign og simulere dets visuelle resultat. Beregningsmodellering på dette område blev populær siden 1999, da Greenberg1 modellerede reaktionen fra en retinal ganglioncelle på ekstracellulære elektriske stimuli. Siden da er beregningsmodellering blevet brugt til at optimere parametrene for den elektriske puls 2,3 eller det geometriske design af elektroden 4,5. På trods af variationen i kompleksitet og forskningsspørgsmål fungerer disse modeller ved at bestemme den elektriske spændingsfordeling i mediet (f.eks. Neuralt væv) og estimere det elektriske respons, som neuronerne i nærheden vil producere på grund af den elektriske spænding.
Den elektriske spændingsfordeling i en leder kan findes ved at løse Poisson-ligningerne6 på alle steder:
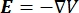
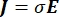
hvor E er det elektriske felt, V det elektriske potentiale, J strømtætheden, og σ er den elektriske ledningsevne. I 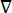 ligningen angives en gradientoperator. I tilfælde af stationær strøm pålægges modellen følgende grænsebetingelser:
ligningen angives en gradientoperator. I tilfælde af stationær strøm pålægges modellen følgende grænsebetingelser:
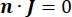
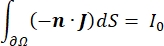
hvor n er det normale for overfladen, repræsenterer Ω grænsen, og I0 repræsenterer den specifikke strøm. Sammen skaber de elektrisk isolering ved de ydre grænser og skaber en strømkilde til en valgt grænse. Hvis vi antager en monopolær punktkilde i et homogent medium med en isotrop ledningsevne, kan det ekstracellulære elektriske potentiale på et vilkårligt sted beregnes med7:
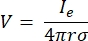
hvor Ie er strømmen og er afstanden mellem elektroden og målepunktet. Når mediet er inhomogent eller anisotropisk, eller elektrodearrayet har flere elektroder, kan en beregningspakke til numerisk løsning af ligningerne være praktisk. En finite-element modelleringssoftware6 opdeler volumenlederen i små sektioner kendt som ‘elementer’. Elementerne er forbundet med hinanden, således at virkningerne af ændring i et element påvirker ændring i andre, og det løser de fysiske ligninger, der tjener til at beskrive disse elementer. Med den stigende beregningshastighed for moderne computere kan denne proces afsluttes inden for få sekunder. Når det elektriske potentiale er beregnet, kan man derefter estimere neuronens elektriske respons.
En neuron sender og modtager information i form af elektriske signaler. Sådanne signaler kommer i to former – graduerede potentialer og handlingspotentialer. Graduerede potentialer er midlertidige ændringer i membranpotentialet, hvor spændingen over membranen bliver mere positiv (depolarisering) eller negativ (hyperpolarisering). Graduerede potentialer har typisk lokaliserede effekter. I celler, der producerer dem, er handlingspotentialer alt-eller-intet-reaktioner, der kan rejse lange afstande langs længden af en axon. Både graduerede og handlingspotentialer er følsomme over for det elektriske såvel som det kemiske miljø. En aktionspotentiel spike kan produceres af forskellige neuronale celletyper, herunder retinale ganglionceller, når et tærskeltransmembranpotentiale krydses. Handlingspotentialet spiking og formering udløser derefter synaptisk transmission af signaler til nedstrøms neuroner. En neuron kan modelleres som et kabel, der er opdelt i cylindriske segmenter, hvor hvert segment har kapacitans og modstand på grund af lipiddobbeltlagsmembranen8. Et neuronberegningsprogram9 kan estimere den elektriske aktivitet af en elektrisk spændende celle ved at diskretisere cellen i flere rum og løse den matematiske model10:
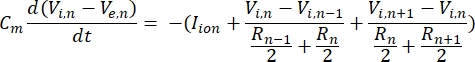
I denne ligning er Cmmembrankapacitansen, V e,n er det ekstracellulære potentiale ved knude n, Vi,n det intracellulære potentiale ved knude n, R n den intracellulære (langsgående) modstand ved knude n, og I-ion er den ioniske strøm, der går gennem ionkanalerne ved knude n. Værdierne af V fra FEM-modellen implementeres som Ve,n for alle knuder i neuronen, når stimuleringen er aktiv.
Transmembranstrømmene fra ionkanaler kan modelleres ved hjælp af Hodgkin-Huxley-formuleringer11:
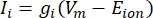
hvor g i er kanalens specifikke konduktans, V m transmembranpotentialet (V i,n – Ve,n) og Eion ionkanalens reverseringspotentiale. For spændingsstyrede kanaler, såsom Na-kanal, introduceres dimensionsløse parametre, m og h, der beskriver sandsynligheden for åbning eller lukning af kanalerne:
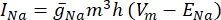
hvor 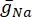 er den maksimale membrankonduktans for den pågældende ionkanal, og værdierne for parametrene m og h er defineret ved differentialligninger:
er den maksimale membrankonduktans for den pågældende ionkanal, og værdierne for parametrene m og h er defineret ved differentialligninger:
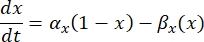
hvor α x og βx er spændingsafhængige funktioner, der definerer ionkanalens hastighedskonstanter. De har normalt form af:
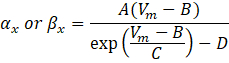
Værdierne af parametrene i disse ligninger, herunder maksimal konduktans, samt konstanterne A, B, C og D, blev typisk fundet fra empiriske målinger.
Med disse byggesten kan modeller af forskellige kompleksiteter bygges ved at følge de beskrevne trin. En FEM-software er nyttig, når Poisson-ligningen ikke kan løses analytisk, såsom i tilfælde af inhomogen eller anisotrop konduktans i volumenlederen, eller når elektrodearrayets geometri er kompleks. Efter at de ekstracellulære potentielle værdier er blevet løst, kan neuronkabelmodellen derefter løses numerisk i neuronberegningssoftwaren. Kombination af de to software muliggør beregning af en kompleks neuroncelle eller netværk til et ikke-ensartet elektrisk felt.
En simpel to-trins model af en retinal ganglioncelle under en suprachoroidal stimulering vil blive bygget ved hjælp af de førnævnte programmer. I denne undersøgelse vil nethindeganglioncellen blive udsat for en række størrelser af elektriske strømimpulser. Placeringen af cellen i forhold til stimulus er også varieret for at vise afstands-tærskelforholdet. Desuden inkluderer undersøgelsen en validering af beregningsresultatet mod en in vivo-undersøgelse af den kortikale aktiveringstærskel ved hjælp af forskellige størrelser af stimuleringselektrode 12 samt en in vitro-undersøgelse, der viser forholdet mellem elektrode-neuronafstanden og aktiveringstærsklen13.
Protocol
Representative Results
Discussion
I dette papir har vi demonstreret en modelleringsarbejdsgang, der kombinerede endeligt element og biofysisk neuronmodellering. Modellen er meget fleksibel, da den kan ændres i sin kompleksitet, så den passer til forskellige formål, og den giver en måde at validere resultaterne mod empiriske fund. Vi demonstrerede også, hvordan vi parameteriserede modellen for at muliggøre automatisering.
To-trins modelleringsmetoden kombinerer fordelene ved at bruge FEM og neuron computational suite til …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denne forskning er finansieret af The National Health and Medical Research Council Project Grant (Grant Number 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurosciences. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

