Computationele modellering van retinale neuronen voor visueel protheseonderzoek - Fundamentele benaderingen
Summary
We vatten een workflow samen om het gedrag van een netvliesneuron computationeel te modelleren als reactie op elektrische stimulatie. Het computationele model is veelzijdig en omvat automatiseringsstappen die nuttig zijn bij het simuleren van een reeks fysiologische scenario’s en het anticiperen op de uitkomsten van toekomstige in vivo / in vitro studies.
Abstract
Computationele modellering is een steeds belangrijkere methode geworden in neurale engineering vanwege het vermogen om gedrag van in vivo en in vitro systemen te voorspellen. Dit heeft als belangrijkste voordeel dat het aantal dieren dat nodig is in een bepaald onderzoek wordt geminimaliseerd door een vaak zeer nauwkeurige voorspelling van fysiologische uitkomsten te bieden. Op het gebied van visuele prothesen heeft computationele modellering een scala aan praktische toepassingen, waaronder het informeren van het ontwerp van een implanteerbare elektrode-array en het voorspellen van visuele waarnemingen die kunnen worden opgewekt door de levering van elektrische impulsen uit de genoemde array. Sommige modellen die in de literatuur worden beschreven, combineren een driedimensionale (3D) morfologie om het elektrische veld te berekenen en een kabelmodel van het neuron of neurale netwerk van belang. Om de toegankelijkheid van deze tweestapsmethode te vergroten voor onderzoekers die mogelijk beperkte eerdere ervaring hebben met computationele modellering, bieden we een video van de fundamentele benaderingen die moeten worden gevolgd om een computationeel model te construeren en te gebruiken bij het voorspellen van de fysiologische en psychofysische uitkomsten van stimulatieprotocollen die worden ingezet via een visuele prothese. De gids omvat de stappen om een 3D-model te bouwen in een eindige elementenmodellering (FEM), de constructie van een retinaal ganglioncelmodel in een multi-compartimentale neuron computationele software, gevolgd door de samensmelting van de twee. Een eindige elementen modelleringssoftware om numeriek fysieke vergelijkingen op te lossen, zou worden gebruikt om elektrische veldverdeling in de elektrische stimulaties van weefsel op te lossen. Vervolgens werd gespecialiseerde software gebruikt om de elektrische activiteiten van een neurale cel of netwerk te simuleren. Om deze tutorial te volgen, zou bekendheid met het werkingsprincipe van een neuroprothese, evenals neurofysiologische concepten (bijv. Actiepotentiaalmechanisme en een goed begrip van het Hodgkin-Huxley-model) vereist zijn.
Introduction
Visuele neuroprothesen zijn een groep apparaten die stimulaties (elektrisch, licht, enz.) leveren aan de neurale cellen in het visuele pad om fosfenen of het gevoel van het zien van het licht te creëren. Het is een behandelingsstrategie die al bijna een decennium klinisch wordt gebruikt voor mensen met permanente blindheid veroorzaakt door degeneratieve retinale ziekten. Typisch, een compleet systeem zou een externe camera bevatten die de visuele informatie rond de gebruiker vastlegt, een voeding en computereenheid om het beeld te verwerken en te vertalen naar een reeks elektrische pulsen, en een geïmplanteerde elektrode-array die het neurale weefsel verbindt en de elektrische pulsen aan de neurale cellen levert. Het werkingsprincipe maakt het mogelijk om een visuele neuroprothese op verschillende plaatsen langs het visuele pad van het netvlies naar de visuele cortex te plaatsen, zolang deze stroomafwaarts van het beschadigde weefsel is. Een meerderheid van het huidige onderzoek in visuele neuroprothesen richt zich op het verhogen van de effectiviteit van de stimulatie en het verbeteren van de ruimtelijke scherpte om een natuurlijker zicht te bieden.
In de inspanningen om de effectiviteit van de stimulatie te verbeteren, is computationele modellering een kosten- en tijdbesparende methode geweest om een protheseontwerp te valideren en de visuele uitkomst ervan te simuleren. Computationele modellering op dit gebied won aan populariteit sinds 1999 toen Greenberg1 de reactie van een retinale ganglioncel op extracellulaire elektrische stimuli modelleerde. Sindsdien is computationele modellering gebruikt om de parameters van de elektrische puls 2,3 of het geometrische ontwerp van de elektrode 4,5 te optimaliseren. Ondanks de variatie in complexiteit en onderzoeksvragen, werken deze modellen door het bepalen van de elektrische spanningsverdeling in het medium (bijvoorbeeld neuraal weefsel) en het schatten van de elektrische respons die de neuronen in de buurt zullen produceren als gevolg van de elektrische spanning.
De elektrische spanningsverdeling in een geleider kan worden gevonden door de Poissonvergelijkingen6 op alle locaties op te lossen:
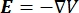
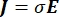
waarbij E het elektrische veld is, V de elektrische potentiaal, J de stroomdichtheid en σ de elektrische geleidbaarheid is. De 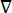 in de vergelijking geeft een verloopoperator aan. In het geval van stationaire stroom worden de volgende randvoorwaarden aan het model opgelegd:
in de vergelijking geeft een verloopoperator aan. In het geval van stationaire stroom worden de volgende randvoorwaarden aan het model opgelegd:
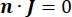
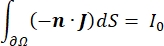
waarbij n de normaalwaarde is voor het oppervlak, Ω de grens vertegenwoordigt en I0 de specifieke stroom. Samen creëren ze elektrische isolatie aan de buitengrenzen en creëren ze een stroombron voor een geselecteerde grens. Als we uitgaan van een monopolaire puntbron in een homogeen medium met een isotrope geleidbaarheid, kan de extracellulaire elektrische potentiaal op een willekeurige locatie worden berekend met7:
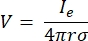
waarbij Ie de stroom is en de afstand tussen de elektrode en het meetpunt. Wanneer het medium inhomogeen of anisotroop is, of de elektrodearray meerdere elektroden heeft, kan een computationele suite om de vergelijkingen numeriek op te lossen handig zijn. Een eindige elementen modelleringssoftware6 verdeelt de volumegeleider in kleine secties die bekend staan als ‘elementen’. De elementen zijn met elkaar verbonden, zodat de effecten van verandering in het ene element verandering in andere beïnvloeden, en het lost de fysieke vergelijkingen op die dienen om deze elementen te beschrijven. Met de toenemende rekensnelheid van moderne computers kan dit proces binnen enkele seconden worden voltooid. Zodra de elektrische potentiaal is berekend, kan men vervolgens de elektrische respons van het neuron schatten.
Een neuron verzendt en ontvangt informatie in de vorm van elektrische signalen. Dergelijke signalen zijn er in twee vormen – graduele potentialen en actiepotentialen. Graduele potentialen zijn tijdelijke veranderingen in de membraanpotentiaal waarbij de spanning over het membraan positiever (depolarisatie) of negatiever (hyperpolarisatie) wordt. Graduele potentialen hebben meestal gelokaliseerde effecten. In cellen die ze produceren, zijn actiepotentialen alles-of-niets-reacties die lange afstanden kunnen afleggen over de lengte van een axon. Zowel graduele als actiepotentialen zijn gevoelig voor zowel de elektrische als de chemische omgeving. Een actiepotentiaalpiek kan worden geproduceerd door verschillende neuronale celtypen, waaronder de retinale ganglioncellen, wanneer een drempeltransmembraanpotentiaal wordt overschreden. Het actiepotentiaal spiking en propagatie activeren vervolgens synaptische overdracht van signalen naar downstream neuronen. Een neuron kan worden gemodelleerd als een kabel die is verdeeld in cilindrische segmenten, waarbij elk segment capaciteit en weerstand heeft als gevolg van het lipide bilayer membraan8. Een neuron computationeel programma9 kan de elektrische activiteit van een elektrisch-exciteerbare cel schatten door de cel in meerdere compartimenten te discreteren en het wiskundige model10 op te lossen:
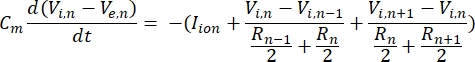
In deze vergelijking is Cmde membraancapaciteit, Ve,n is de extracellulaire potentiaal op knooppunt n, Vi,n de intracellulaire potentiaal op knooppunt n, Rnde intracellulaire (longitudinale) weerstand op knooppunt n, en I-ion is de ionische stroom die door de ionkanalen op knooppunt n gaat. De waarden van V uit het FEM-model worden geïmplementeerd als Ve,n voor alle knooppunten in het neuron wanneer de stimulatie actief is.
De transmembraanstromen van ionkanalen kunnen worden gemodelleerd met behulp van Hodgkin-Huxley-formuleringen11:
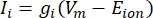
waarbij gi de specifieke geleiding van het kanaal is, Vm de transmembraanpotentiaal (Vi,n – Ve,n) en Eion de omkeerpotentiaal van het ionenkanaal. Voor spanningsafhankelijke kanalen, zoals Na-kanaal, worden dimensieloze parameters, m en h, die de kans op het openen of sluiten van de kanalen beschrijven, geïntroduceerd:
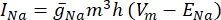
waarbij 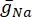 de maximale membraangeleiding voor het specifieke ionkanaal is en de waarden van de parameters m en h worden bepaald door differentiaalvergelijkingen:
de maximale membraangeleiding voor het specifieke ionkanaal is en de waarden van de parameters m en h worden bepaald door differentiaalvergelijkingen:
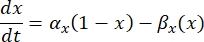
waarbij αx en βx spanningsafhankelijke functies zijn die de snelheidsconstanten van het ionkanaal definiëren. Ze hebben over het algemeen de vorm:
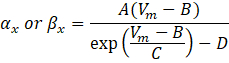
De waarden van de parameters in deze vergelijkingen, inclusief maximale geleiding, evenals de constanten A, B, C en D, werden meestal gevonden uit empirische metingen.
Met deze bouwstenen kunnen modellen van verschillende complexiteiten worden gebouwd door de beschreven stappen te volgen. Een FEM-software is nuttig wanneer de Poisson-vergelijking analytisch niet kan worden opgelost, zoals in het geval van inhomogene of anisotrope geleiding in de volumegeleider of wanneer de geometrie van de elektrodearray complex is. Nadat de extracellulaire potentiaalwaarden zijn opgelost, kan het neuronkabelmodel numeriek worden opgelost in de neuron computationele software. Het combineren van de twee software maakt de berekening van een complexe neuroncel of netwerk naar een niet-uniform elektrisch veld mogelijk.
Een eenvoudig tweestapsmodel van een retinale ganglioncel onder een suprachoroïdale stimulatie zal worden gebouwd met behulp van de bovengenoemde programma’s. In deze studie zal de retinale ganglioncel worden onderworpen aan een reeks magnituden van elektrische stroompulsen. De locatie van de cel ten opzichte van de stimulus wordt ook gevarieerd om de afstand-drempelrelatie weer te geven. Bovendien omvat de studie een validatie van het computationele resultaat tegen een in vivo studie van de corticale activeringsdrempel met behulp van verschillende groottes van stimulatie-elektrode12, evenals een in vitro studie die de relatie tussen de elektrode-neuronafstand en de activeringsdrempel13 aantoont.
Protocol
Representative Results
Discussion
In dit artikel hebben we een modelleringsworkflow gedemonstreerd die eindige elementen en biofysische neuronmodellering combineerde. Het model is zeer flexibel, omdat het in zijn complexiteit kan worden aangepast aan verschillende doeleinden, en het biedt een manier om de resultaten te valideren tegen empirische bevindingen. We hebben ook gedemonstreerd hoe we het model hebben geparametriseerd om automatisering mogelijk te maken.
De tweestapsmodelleringsmethode combineert de voordelen van het …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek wordt gefinancierd door the National Health and Medical Research Council Project Grant (Grant Number 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurosciences. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

