Computational Modeling of Retinal Neurons for Visual Prosthesis Research - Grundlegende Ansätze
Summary
Wir fassen einen Workflow zusammen, um das Verhalten eines Netzhautneurons als Reaktion auf elektrische Stimulation rechnerisch zu modellieren. Das Berechnungsmodell ist vielseitig und umfasst Automatisierungsschritte, die nützlich sind, um eine Reihe von physiologischen Szenarien zu simulieren und die Ergebnisse zukünftiger In-vivo/In-vitro-Studien zu antizipieren.
Abstract
Die computergestützte Modellierung ist aufgrund ihrer Fähigkeit, das Verhalten von In-vivo- und In-vitro-Systemen vorherzusagen, zu einer immer wichtigeren Methode im neuronalen Engineering geworden. Dies hat den entscheidenden Vorteil, dass die Anzahl der in einer bestimmten Studie benötigten Tiere minimiert wird, indem eine oft sehr genaue Vorhersage physiologischer Ergebnisse ermöglicht wird. Auf dem Gebiet der visuellen Prothese hat die computergestützte Modellierung eine Reihe praktischer Anwendungen, einschließlich der Information über das Design eines implantierbaren Elektrodenarrays und die Vorhersage visueller Wahrnehmungen, die durch die Abgabe elektrischer Impulse von diesem Array ausgelöst werden können. Einige in der Literatur beschriebene Modelle kombinieren eine dreidimensionale (3D) Morphologie zur Berechnung des elektrischen Feldes und ein Kabelmodell des interessierenden Neurons oder neuronalen Netzwerks. Um die Zugänglichkeit dieser zweistufigen Methode für Forscher zu erhöhen, die möglicherweise nur begrenzte Erfahrung mit der computergestützten Modellierung haben, stellen wir ein Video der grundlegenden Ansätze zur Verfügung, die zur Konstruktion eines Computermodells zu ergreifen sind, und verwenden es zur Vorhersage der physiologischen und psychophysischen Ergebnisse von Stimulationsprotokollen, die über eine visuelle Prothese. Der Leitfaden umfasst die Schritte zum Erstellen eines 3D-Modells in einer Finite-Elemente-Modellierungssoftware (FEM), die Konstruktion eines retinalen Ganglienzellmodells in einer multikompartimentären Neuronen-Computersoftware, gefolgt von der Verschmelzung der beiden. Eine Finite-Elemente-Modellierungssoftware zur numerischen Lösung physikalischer Gleichungen würde verwendet werden, um die elektrische Feldverteilung in den elektrischen Stimulationen von Gewebe zu lösen. Dann wurde eine spezielle Software verwendet, um die elektrischen Aktivitäten einer neuronalen Zelle oder eines Netzwerks zu simulieren. Um diesem Tutorial zu folgen, wäre die Vertrautheit mit dem Funktionsprinzip einer Neuroprothese sowie neurophysiologischen Konzepten (z. B. Aktionspotentialmechanismus und Verständnis des Hodgkin-Huxley-Modells) erforderlich.
Introduction
Visuelle Neuroprothesen sind eine Gruppe von Geräten, die Stimulationen (elektrisch, Licht usw.) an die Nervenzellen auf dem Sehweg abgeben, um Phosphene oder das Gefühl des Sehens des Lichts zu erzeugen. Es ist eine Behandlungsstrategie, die seit fast einem Jahrzehnt für Menschen mit dauerhafter Erblindung durch degenerative Netzhauterkrankungen klinisch eingesetzt wird. Typischerweise würde ein komplettes System eine externe Kamera umfassen, die die visuellen Informationen um den Benutzer herum erfasst, ein Netzteil und eine Recheneinheit, um das Bild zu verarbeiten und in eine Reihe von elektrischen Impulsen zu übersetzen, und ein implantiertes Elektrodenarray, das das neuronale Gewebe verbindet und die elektrischen Impulse an die Nervenzellen liefert. Das Funktionsprinzip ermöglicht es, eine visuelle Neuroprothese an verschiedenen Stellen entlang des Sehwegs von der Netzhaut zum visuellen Kortex zu platzieren, solange sie dem geschädigten Gewebe nachgeschaltet ist. Ein Großteil der aktuellen Forschung im Bereich visueller Neuroprothesen konzentriert sich auf die Erhöhung der Wirksamkeit der Stimulation und die Verbesserung der räumlichen Sehschärfe, um ein natürlicheres Sehen zu ermöglichen.
Bei den Bemühungen, die Wirksamkeit der Stimulation zu verbessern, war die computergestützte Modellierung eine kostengünstige und zeiteffiziente Methode, um ein Prothesendesign zu validieren und sein visuelles Ergebnis zu simulieren. Computergestützte Modellierung in diesem Bereich gewann seit 1999 an Popularität, als Greenberg1 die Reaktion einer retinalen Ganglienzelle auf extrazelluläre elektrische Reize modellierte. Seitdem wird die computergestützte Modellierung verwendet, um die Parameter des elektrischen Impulses2,3 oder das geometrische Design der Elektrode 4,5 zu optimieren. Trotz der unterschiedlichen Komplexität und der Forschungsfragen arbeiten diese Modelle, indem sie die elektrische Spannungsverteilung im Medium (z. B. Nervengewebe) bestimmen und die elektrische Reaktion abschätzen, die die Neuronen in der Nähe aufgrund der elektrischen Spannung erzeugen.
Die elektrische Spannungsverteilung in einem Leiter kann durch Lösen der Poisson-Gleichungen6 an allen Stellen ermittelt werden:
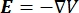
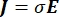
wobei E das elektrische Feld, V das elektrische Potential, J die Stromdichte und σ die elektrische Leitfähigkeit ist. Die 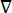 in der Gleichung gibt einen Gradientenoperator an. Bei stationärem Strom werden dem Modell folgende Randbedingungen auferlegt:
in der Gleichung gibt einen Gradientenoperator an. Bei stationärem Strom werden dem Modell folgende Randbedingungen auferlegt:
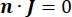
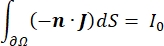
wobei n die Senkrechte zur Fläche ist, Ω die Grenze darstellt und I0 den spezifischen Strom darstellt. Zusammen erzeugen sie eine elektrische Isolierung an den Außengrenzen und erzeugen eine Stromquelle für eine ausgewählte Grenze. Wenn wir eine monopolare Punktquelle in einem homogenen Medium mit isotroper Leitfähigkeit annehmen, kann das extrazelluläre elektrische Potential an einem beliebigen Ort durch7 berechnet werden:
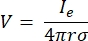
wobei Ie der Strom und der Abstand zwischen der Elektrode und dem Messpunkt ist. Wenn das Medium inhomogen oder anisotrop ist oder das Elektrodenarray mehrere Elektroden aufweist, kann eine Berechnungssuite zur numerischen Lösung der Gleichungen praktisch sein. Eine Finite-Elemente-Modellierungssoftware6 zerlegt den Volumenleiter in kleine Abschnitte, die als “Elemente” bezeichnet werden. Die Elemente sind miteinander verbunden, so dass die Auswirkungen der Veränderung in einem Element die Veränderung in anderen beeinflussen, und es löst die physikalischen Gleichungen, die zur Beschreibung dieser Elemente dienen. Mit der steigenden Rechengeschwindigkeit moderner Computer kann dieser Prozess innerhalb von Sekunden abgeschlossen werden. Sobald das elektrische Potential berechnet ist, kann man die elektrische Reaktion des Neurons abschätzen.
Ein Neuron sendet und empfängt Informationen in Form von elektrischen Signalen. Solche Signale gibt es in zwei Formen – abgestufte Potentiale und Aktionspotentiale. Abstufte Potentiale sind vorübergehende Änderungen des Membranpotentials, wobei die Spannung über der Membran positiver (Depolarisation) oder negativer (Hyperpolarisation) wird. Abgestufte Potenziale haben typischerweise lokalisierte Effekte. In Zellen, die sie produzieren, sind Aktionspotentiale Alles-oder-Nichts-Reaktionen, die lange Strecken entlang der Länge eines Axons zurücklegen können. Sowohl abgestufte als auch Aktionspotentiale sind empfindlich gegenüber der elektrischen und chemischen Umgebung. Eine Aktionspotentialspitze kann von verschiedenen neuronalen Zelltypen, einschließlich der retinalen Ganglienzellen, erzeugt werden, wenn ein Schwellentransmembranpotential überschritten wird. Das Aktionspotential Spiking und die Ausbreitung lösen dann die synaptische Übertragung von Signalen an nachgeschaltete Neuronen aus. Ein Neuron kann als Kabel modelliert werden, das in zylindrische Segmente unterteilt ist, wobei jedes Segment aufgrund der Lipiddoppelschichtmembran8 Kapazität und Widerstand aufweist. Ein Neuronen-Rechenprogramm9 kann die elektrische Aktivität einer elektrisch erregbaren Zelle abschätzen, indem es die Zelle in mehrere Kompartimente diskretisiert und das mathematische Modell10 löst:
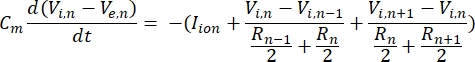
In dieser Gleichung ist Cmdie Membrankapazität, V e,n ist das extrazelluläre Potential am Knoten n, Vi,n das intrazelluläre Potential am Knoten n, R n der intrazelluläre (longitudinale) Widerstand am Knoten n und I-Ion ist der Ionenstrom, der durch die Ionenkanäle am Knoten nfließt. Die Werte von V aus dem FEM-Modell werden als Ve,n für alle Knoten im Neuron implementiert, wenn die Stimulation aktiv ist.
Die Transmembranströme aus Ionenkanälen können unter Verwendung der Hodgkin-Huxley-Formulierungen11 modelliert werden:
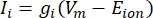
wobei g i die spezifische Leitfähigkeit des Kanals, V m das Transmembranpotential (V i,n – Ve,n) und E Ion das Umkehrpotential des Ionenkanals ist. Für spannungsabhängige Kanäle wie Na-Kanal werden dimensionslose Parameter m und h eingeführt, die die Wahrscheinlichkeit des Öffnens oder Schließens der Kanäle beschreiben:
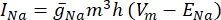
wobei 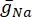 die maximale Membranleitfähigkeit für den jeweiligen Ionenkanal ist und die Werte der Parameter m und h durch Differentialgleichungen definiert sind:
die maximale Membranleitfähigkeit für den jeweiligen Ionenkanal ist und die Werte der Parameter m und h durch Differentialgleichungen definiert sind:
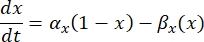
wobei α x und βx spannungsabhängige Funktionen sind, die die Ratenkonstanten des Ionenkanals definieren. Sie haben im Allgemeinen die Form:
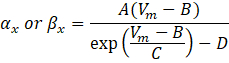
Die Werte der Parameter in diesen Gleichungen, einschließlich der maximalen Leitfähigkeit, sowie die Konstanten A, B, C und D, wurden typischerweise aus empirischen Messungen gefunden.
Mit diesen Bausteinen können Modelle unterschiedlicher Komplexität erstellt werden, indem die beschriebenen Schritte ausgeführt werden. Eine FEM-Software ist nützlich, wenn die Poisson-Gleichung nicht analytisch gelöst werden kann, z. B. bei inhomogener oder anisotroper Leitfähigkeit im Volumenleiter oder wenn die Geometrie des Elektrodenarrays komplex ist. Nachdem die extrazellulären Potentialwerte gelöst wurden, kann das Neuronenkabelmodell in der Neuronen-Rechensoftware numerisch gelöst werden. Die Kombination der beiden Software ermöglicht die Berechnung einer komplexen Neuronenzelle oder eines Netzwerks zu einem ungleichmäßigen elektrischen Feld.
Ein einfaches zweistufiges Modell einer retinalen Ganglienzelle unter suprachoroidaler Stimulation wird mit den oben genannten Programmen erstellt. In dieser Studie wird die retinale Ganglienzelle einer Reihe von Größenordnungen elektrischer Stromimpulse ausgesetzt. Die Position der Zelle relativ zum Reiz wird ebenfalls variiert, um die Distanz-Schwellen-Beziehung zu zeigen. Darüber hinaus umfasst die Studie eine Validierung des Berechnungsergebnisses gegen eine In-vivo-Studie der kortikalen Aktivierungsschwelle unter Verwendung unterschiedlicher Größen der Stimulationselektrode12 sowie eine In-vitro-Studie, die die Beziehung zwischen dem Elektroden-Neuron-Abstand und der Aktivierungsschwelle 13 zeigt.
Protocol
Representative Results
Discussion
In diesem Artikel haben wir einen Modellierungsworkflow demonstriert, der Finite-Elemente- und biophysikalische Neuronenmodellierung kombiniert. Das Modell ist sehr flexibel, da es in seiner Komplexität an verschiedene Zwecke angepasst werden kann und eine Möglichkeit bietet, die Ergebnisse anhand empirischer Befunde zu validieren. Wir haben auch gezeigt, wie wir das Modell parametrisiert haben, um eine Automatisierung zu ermöglichen.
Die zweistufige Modellierungsmethode kombiniert die Vort…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wird durch den National Health and Medical Research Council Project Grant (Grant Number 1109056) finanziert.
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurosciences. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

