Modellazione computazionale di neuroni retinici per la ricerca di protesi visive - Approcci fondamentali
Summary
Riassumiamo un flusso di lavoro per modellare computazionalmente i comportamenti di un neurone retinico in risposta alla stimolazione elettrica. Il modello computazionale è versatile e include fasi di automazione utili per simulare una serie di scenari fisiologici e anticipare i risultati di futuri studi in vivo / in vitro .
Abstract
La modellazione computazionale è diventata un metodo sempre più importante nell’ingegneria neurale grazie alla sua capacità di prevedere i comportamenti dei sistemi in vivo e in vitro . Ciò ha il vantaggio chiave di ridurre al minimo il numero di animali richiesti in un determinato studio fornendo una previsione spesso molto precisa dei risultati fisiologici. Nel campo della protesi visiva, la modellazione computazionale ha una serie di applicazioni pratiche, tra cui informare la progettazione di un array di elettrodi impiantabili e la previsione delle percezioni visive che possono essere suscitate attraverso la consegna di impulsi elettrici da detto array. Alcuni modelli descritti in letteratura combinano una morfologia tridimensionale (3D) per calcolare il campo elettrico e un modello a cavo del neurone o della rete neurale di interesse. Per aumentare l’accessibilità di questo metodo in due fasi ai ricercatori che potrebbero avere una limitata esperienza precedente nella modellazione computazionale, forniamo un video degli approcci fondamentali da adottare per costruire un modello computazionale e utilizzarlo nella previsione dei risultati fisiologici e psicofisici dei protocolli di stimolazione implementati tramite una protesi visiva. La guida comprende i passaggi per costruire un modello 3D in un software di modellazione ad elementi finiti (FEM), la costruzione di un modello di cellule gangliari retiniche in un software computazionale neuronale multicompartimentale, seguito dalla fusione dei due. Un software di modellazione ad elementi finiti per risolvere numericamente equazioni fisiche verrebbe utilizzato per risolvere la distribuzione del campo elettrico nelle stimolazioni elettriche dei tessuti. Quindi, è stato utilizzato un software specializzato per simulare le attività elettriche di una cellula neurale o di una rete. Per seguire questo tutorial, sarebbe necessaria familiarità con il principio di funzionamento di una neuroprotesi, così come i concetti neurofisiologici (ad esempio, il meccanismo del potenziale d’azione e la comprensione del modello di Hodgkin-Huxley).
Introduction
Le neuroprotesi visive sono un gruppo di dispositivi che forniscono stimolazioni (elettriche, luminose, ecc.) alle cellule neurali nel percorso visivo per creare fosfeni o sensazione di vedere la luce. È una strategia di trattamento che è stata in uso clinico per quasi un decennio per le persone con cecità permanente causata da malattie degenerative della retina. In genere, un sistema completo includerebbe una telecamera esterna che cattura le informazioni visive intorno all’utente, un alimentatore e un’unità di calcolo per elaborare e tradurre l’immagine in una serie di impulsi elettrici e un array di elettrodi impiantati che interfaccia il tessuto neurale e fornisce gli impulsi elettrici alle cellule neurali. Il principio di funzionamento consente di posizionare una neuroprotesi visiva in diversi siti lungo il percorso visivo dalla retina alla corteccia visiva, purché sia a valle del tessuto danneggiato. La maggior parte della ricerca attuale in neuroprotesi visive si concentra sull’aumento dell’efficacia della stimolazione e sul miglioramento dell’acuità spaziale per fornire una visione più naturale.
Negli sforzi per migliorare l’efficacia della stimolazione, la modellazione computazionale è stata un metodo economico e tempestivo per convalidare un progetto di protesi e simularne il risultato visivo. La modellazione computazionale in questo campo ha guadagnato popolarità dal 1999 quando Greenberg1 ha modellato la risposta di una cellula gangliare retinica agli stimoli elettrici extracellulari. Da allora, la modellazione computazionale è stata utilizzata per ottimizzare i parametri dell’impulso elettrico2,3 o il design geometrico dell’elettrodo 4,5. Nonostante la variazione della complessità e delle domande di ricerca, questi modelli funzionano determinando la distribuzione della tensione elettrica nel mezzo (ad esempio, il tessuto neurale) e stimando la risposta elettrica che i neuroni nelle vicinanze produrranno a causa della tensione elettrica.
La distribuzione della tensione elettrica in un conduttore può essere trovata risolvendo le equazioni di Poisson6 in tutte le posizioni:
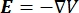
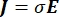
dove E è il campo elettrico, V il potenziale elettrico, J la densità di corrente e σ è la conduttività elettrica. L’equazione 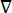 indica un operatore gradiente. Nel caso di corrente stazionaria, al modello sono imposte le seguenti condizioni al contorno:
indica un operatore gradiente. Nel caso di corrente stazionaria, al modello sono imposte le seguenti condizioni al contorno:
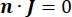
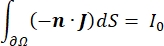
dove n è la normale alla superficie, Ω rappresenta il limite e I0 rappresenta la corrente specifica. Insieme, creano isolamento elettrico ai confini esterni e creano una sorgente di corrente per un limite selezionato. Se assumiamo una sorgente puntiforme monopolare in un mezzo omogeneo con una conduttività isotropa, il potenziale elettrico extracellulare in una posizione arbitraria può essere calcolato da7:
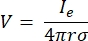
dove I e è la corrente e è la distanza tra l’elettrodo e il punto di misura. Quando il mezzo è disomogeneo o anisotropo, o l’array di elettrodi ha più elettrodi, una suite computazionale per risolvere numericamente le equazioni può essere conveniente. Un software di modellazione agli elementi finiti6 suddivide il conduttore di volume in piccole sezioni note come “elementi”. Gli elementi sono interconnessi tra loro in modo tale che gli effetti del cambiamento in un elemento influenzano il cambiamento in altri, e risolve le equazioni fisiche che servono a descrivere questi elementi. Con la crescente velocità di calcolo dei computer moderni, questo processo può essere completato in pochi secondi. Una volta calcolato il potenziale elettrico, si può quindi stimare la risposta elettrica del neurone.
Un neurone invia e riceve informazioni sotto forma di segnali elettrici. Tali segnali si presentano in due forme: potenziali graduati e potenziali d’azione. I potenziali graduati sono cambiamenti temporanei del potenziale di membrana in cui la tensione attraverso la membrana diventa più positiva (depolarizzazione) o negativa (iperpolarizzazione). I potenziali graduati hanno tipicamente effetti localizzati. Nelle cellule che li producono, i potenziali d’azione sono risposte “tutto o niente” che possono percorrere lunghe distanze lungo la lunghezza di un assone. Sia i potenziali graduati che quelli d’azione sono sensibili all’ambiente elettrico e chimico. Un picco di potenziale d’azione può essere prodotto da vari tipi di cellule neuronali, comprese le cellule gangliari retiniche, quando viene attraversato un potenziale transmembrana di soglia. Il potenziale d’azione e la propagazione innescano quindi la trasmissione sinaptica dei segnali ai neuroni a valle. Un neurone può essere modellato come un cavo diviso in segmenti cilindrici, dove ogni segmento ha capacità e resistenza a causa della membrana lipidica a doppio strato8. Un programma computazionale neuronale9 può stimare l’attività elettrica di una cellula elettricamente eccitabile discretizzando la cellula in più compartimenti e risolvendo il modello matematico10:
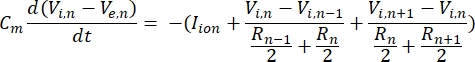
In questa equazione, Cmè la capacità della membrana, V e,n è il potenziale extracellulare al nodo n, V i,n il potenziale intracellulare al nodo n, R n la resistenza intracellulare (longitudinale) al nodo n e loione I è la corrente ionica che attraversa i canali ionici al nodo n. I valori di V dal modello FEM sono implementati come Ve,n per tutti i nodi del neurone quando la stimolazione è attiva.
Le correnti transmembrana dai canali ionici possono essere modellate usando le formulazioni di Hodgkin-Huxley11:
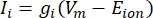
dove g i è la conduttanza specifica del canale, V m il potenziale transmembrana (V i,n – Ve,n) e lo ione E il potenziale di inversione del canale ionico. Per i canali voltaggio-dipendenti, come il canale Na, vengono introdotti parametri adimensionali, m e h, che descrivono la probabilità di apertura o chiusura dei canali:
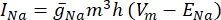
dove 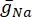 è la massima conduttanza di membrana per il particolare canale ionico, e i valori dei parametri m e h sono definiti da equazioni differenziali:
è la massima conduttanza di membrana per il particolare canale ionico, e i valori dei parametri m e h sono definiti da equazioni differenziali:
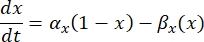
dove α x e βx sono funzioni dipendenti dalla tensione che definiscono le costanti di velocità del canale ionico. Generalmente assumono la forma:
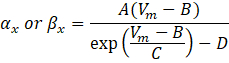
I valori dei parametri in queste equazioni, inclusa la conduttanza massima, così come le costanti A, B, C e D, sono stati tipicamente trovati da misurazioni empiriche.
Con questi elementi costitutivi, è possibile creare modelli di diversa complessità seguendo i passaggi descritti. Un software FEM è utile quando l’equazione di Poisson non può essere risolta analiticamente, come nel caso di conduttanza disomogenea o anisotropa nel conduttore di volume o quando la geometria dell’array di elettrodi è complessa. Dopo che i valori di potenziale extracellulare sono stati risolti, il modello del cavo neuronale può essere risolto numericamente nel software computazionale del neurone. La combinazione dei due software consente il calcolo di una cellula o rete di neuroni complessi in un campo elettrico non uniforme.
Un semplice modello in due fasi di una cellula gangliare retinica sotto una stimolazione sopracoroideale sarà costruito utilizzando i programmi di cui sopra. In questo studio, la cellula gangliare retinica sarà sottoposta a una gamma di grandezze di impulsi di corrente elettrica. Anche la posizione della cellula rispetto allo stimolo viene variata per mostrare la relazione distanza-soglia. Inoltre, lo studio include una convalida del risultato computazionale rispetto a uno studio in vivo della soglia di attivazione corticale utilizzando diverse dimensioni dell’elettrodo di stimolazione12, nonché uno studio in vitro che mostra la relazione tra la distanza elettrodo-neurone e la soglia di attivazione13.
Protocol
Representative Results
Discussion
In questo articolo, abbiamo dimostrato un flusso di lavoro di modellazione che combina la modellazione degli elementi finiti e dei neuroni biofisici. Il modello è altamente flessibile, in quanto può essere modificato nella sua complessità per adattarsi a scopi diversi e fornisce un modo per convalidare i risultati rispetto ai risultati empirici. Abbiamo anche dimostrato come abbiamo parametrizzato il modello per consentire l’automazione.
Il metodo di modellazione in due fasi combina i vanta…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è finanziata dal National Health and Medical Research Council Project Grant (Grant Number 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurosciences. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

