Beräkningsmodellering av retinala neuroner för visuell protesforskning - Grundläggande tillvägagångssätt
Summary
Vi sammanfattar ett arbetsflöde för att beräkningsmässigt modellera en retinal neurons beteenden som svar på elektrisk stimulering. Beräkningsmodellen är mångsidig och inkluderar automatiseringssteg som är användbara för att simulera en rad fysiologiska scenarier och förutse resultaten av framtida in vivo / in vitro-studier .
Abstract
Beräkningsmodellering har blivit en allt viktigare metod inom neuralteknik på grund av dess förmåga att förutsäga beteenden hos in vivo – och in vitro-system . Detta har den viktigaste fördelen att minimera antalet djur som krävs i en given studie genom att ge en ofta mycket exakt förutsägelse av fysiologiska resultat. Inom området visuell protes har beräkningsmodellering en rad praktiska tillämpningar, inklusive information om utformningen av en implanterbar elektroduppsättning och förutsägelse av visuella uppfattningar som kan framkallas genom leverans av elektriska impulser från nämnda array. Vissa modeller som beskrivs i litteraturen kombinerar en tredimensionell (3D) morfologi för att beräkna det elektriska fältet och en kabelmodell av neuron eller neuralt nätverk av intresse. För att öka tillgängligheten av denna tvåstegsmetod för forskare som kan ha begränsad tidigare erfarenhet av beräkningsmodellering, tillhandahåller vi en video av de grundläggande tillvägagångssätten som ska tas för att konstruera en beräkningsmodell och använda den för att förutsäga de fysiologiska och psykofysiska resultaten av stimuleringsprotokoll som används via en visuell protes. Guiden omfattar stegen för att bygga en 3D-modell i en programvara för finita elementmodellering (FEM), konstruktionen av en retinal ganglioncellmodell i en multi-compartmental neuron beräkningsprogramvara, följt av sammanslagningen av de två. En finita elementmodelleringsprogramvara för att numeriskt lösa fysiska ekvationer skulle användas för att lösa elektrisk fältfördelning i de elektriska stimuleringarna av vävnad. Därefter användes specialiserad programvara för att simulera de elektriska aktiviteterna i en neural cell eller ett nätverk. För att följa denna handledning krävs förtrogenhet med arbetsprincipen för en neuroprostes, såväl som neurofysiologiska begrepp (t.ex. åtgärdspotentialmekanism och en förståelse för Hodgkin-Huxley-modellen).
Introduction
Visuella neuroproteser är en grupp enheter som levererar stimuleringar (elektriska, ljus, etc.) till nervcellerna i den visuella vägen för att skapa fosfener eller känsla av att se ljuset. Det är en behandlingsstrategi som har varit i klinisk användning i nästan ett decennium för personer med permanent blindhet orsakad av degenerativa näthinnesjukdomar. Vanligtvis skulle ett komplett system innehålla en extern kamera som fångar den visuella informationen runt användaren, en strömförsörjnings- och datorenhet för att bearbeta och översätta bilden till en serie elektriska pulser och en implanterad elektroduppsättning som gränsar till nervvävnaden och levererar de elektriska pulserna till nervcellerna. Arbetsprincipen gör att en visuell neuroprotes kan placeras på olika platser längs den visuella vägen från näthinnan till den visuella cortexen, så länge den är nedströms från den skadade vävnaden. En majoritet av aktuell forskning inom visuella neuroproteser fokuserar på att öka effekten av stimuleringen och förbättra den rumsliga skärpan för att ge en mer naturlig syn.
I ansträngningarna att förbättra effekten av stimuleringen har beräkningsmodellering varit en kostnads- och tidseffektiv metod för att validera en protesdesign och simulera dess visuella resultat. Beräkningsmodellering inom detta område blev populär sedan 1999 eftersom Greenberg1 modellerade svaret från en retinal ganglioncell till extracellulära elektriska stimuli. Sedan dess har beräkningsmodellering använts för att optimera parametrarna för den elektriska pulsen 2,3 eller den geometriska utformningen av elektroden 4,5. Trots variationen i komplexitet och forskningsfrågor fungerar dessa modeller genom att bestämma den elektriska spänningsfördelningen i mediet (t.ex. nervvävnad) och uppskatta det elektriska svaret som neuronerna i närheten kommer att producera på grund av den elektriska spänningen.
Den elektriska spänningsfördelningen i en ledare kan hittas genom att lösa Poisson-ekvationerna6 på alla platser:
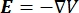
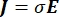
där E är det elektriska fältet, V den elektriska potentialen, J strömtätheten och σ är den elektriska ledningsförmågan. I 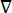 ekvationen anges en gradientoperator. När det gäller stationär ström åläggs modellen följande randvillkor:
ekvationen anges en gradientoperator. När det gäller stationär ström åläggs modellen följande randvillkor:
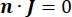
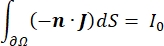
där n är det normala till ytan, Ω representerar gränsen och I0 representerar den specifika strömmen. Tillsammans skapar de elektrisk isolering vid de yttre gränserna och skapar en strömkälla för en vald gräns. Om vi antar en monopolär punktkälla i ett homogent medium med en isotrop konduktivitet kan den extracellulära elektriska potentialen vid en godtycklig plats beräknas med7:
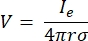
där Ie är strömmen och är avståndet mellan elektroden och mätpunkten. När mediet är inhomogent eller anisotropt, eller elektroduppsättningen har flera elektroder, kan en beräkningssvit för att numeriskt lösa ekvationerna vara bekväm. En finita elementmodelleringsprogramvara6 delar upp volymledaren i små sektioner som kallas “element”. Elementen är sammankopplade med varandra så att effekterna av förändring i ett element påverkar förändring i andra, och det löser de fysiska ekvationerna som tjänar till att beskriva dessa element. Med den ökande beräkningshastigheten hos moderna datorer kan denna process slutföras inom några sekunder. När den elektriska potentialen har beräknats kan man sedan uppskatta neuronens elektriska svar.
En neuron skickar och tar emot information i form av elektriska signaler. Sådana signaler finns i två former – graderade potentialer och åtgärdspotentialer. Graderade potentialer är tillfälliga förändringar av membranpotentialen där spänningen över membranet blir mer positiv (depolarisering) eller negativ (hyperpolarisering). Graderade potentialer har vanligtvis lokaliserade effekter. I celler som producerar dem är åtgärdspotentialer allt-eller-inget-svar som kan resa långa sträckor längs en axon. Både graderade och åtgärdspotentialer är känsliga för den elektriska såväl som den kemiska miljön. En åtgärdspotentialspik kan produceras av olika neuronala celltyper, inklusive retinala ganglionceller, när en tröskeltransmembranpotential korsas. Åtgärdspotentialen spikning och förökning utlöser sedan synaptisk överföring av signaler till nedströms neuroner. En neuron kan modelleras som en kabel som är uppdelad i cylindriska segment, där varje segment har kapacitans och motstånd på grund av lipid-dubbelskiktsmembranet8. Ett neuronberäkningsprogram9 kan uppskatta den elektriska aktiviteten hos en elektriskt excitabel cell genom att diskretisera cellen i flera fack och lösa den matematiska modellen10:
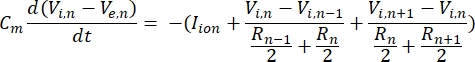
I denna ekvation är Cmmembrankapacitansen, V e,n är den extracellulära potentialen vid nod n, Vi,n den intracellulära potentialen vid nod n, R n det intracellulära (longitudinella) motståndet vid nod n och I-jon är jonströmmen som går genom jonkanalerna vid nod n. Värdena för V från FEM-modellen implementeras som Ve,n för alla noder i neuronen när stimuleringen är aktiv.
Transmembranströmmarna från jonkanaler kan modelleras med hjälp av Hodgkin-Huxley-formuleringar11:
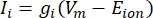
där g i är kanalens specifika konduktans, V m transmembranpotentialen (V i,n – Ve,n) och Ejonjonens reverseringspotential. För spänningsstyrda kanaler, såsom Na-kanal, införs dimensionslösa parametrar, m och h, som beskriver sannolikheten för öppning eller stängning av kanalerna:
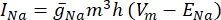
där 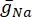 är den maximala membrankonduktansen för den specifika jonkanalen, och värdena för parametrarna m och h definieras av differentialekvationer:
är den maximala membrankonduktansen för den specifika jonkanalen, och värdena för parametrarna m och h definieras av differentialekvationer:
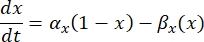
där α x och βx är spänningsberoende funktioner som definierar jonkanalens hastighetskonstanter. De har i allmänhet formen av:
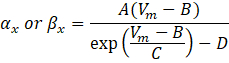
Värdena för parametrarna i dessa ekvationer, inklusive maximal konduktans, liksom konstanterna A, B, C och D, hittades vanligtvis från empiriska mätningar.
Med dessa byggstenar kan modeller av olika komplexitet byggas genom att följa stegen som beskrivs. En FEM-programvara är användbar när Poisson-ekvationen inte kan lösas analytiskt, såsom i fallet med inhomogen eller anisotrop konduktans i volymledaren eller när geometrin hos elektroduppsättningen är komplex. Efter att de extracellulära potentialvärdena har lösts kan neuronkabelmodellen sedan lösas numeriskt i neuronberäkningsprogramvaran. Genom att kombinera de två programvarorna kan man beräkna en komplex neuroncell eller ett nätverk till ett ojämnt elektriskt fält.
En enkel tvåstegsmodell av en retinal ganglioncell under en suprachoroidal stimulering kommer att byggas med hjälp av ovannämnda program. I denna studie kommer retinal ganglioncellen att utsättas för ett antal storheter av elektriska strömpulser. Cellens placering i förhållande till stimulansen varieras också för att visa avståndet och tröskelförhållandet. Dessutom inkluderar studien en validering av beräkningsresultatet mot en in vivo-studie av den kortikala aktiveringströskeln med olika storlekar av stimuleringselektrod12, samt en in vitro-studie som visar förhållandet mellan elektrod-neuronavståndet och aktiveringströskeln13.
Protocol
Representative Results
Discussion
I denna uppsats har vi demonstrerat ett modelleringsarbetsflöde som kombinerade finita element och biofysiska neuronmodellering. Modellen är mycket flexibel, eftersom den kan modifieras i sin komplexitet för att passa olika syften, och den ger ett sätt att validera resultaten mot empiriska resultat. Vi demonstrerade också hur vi parametriserade modellen för att möjliggöra automatisering.
Tvåstegsmodelleringsmetoden kombinerar fördelarna med att använda FEM och neuronberäkningssvit …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denna forskning finansieras av The National Health and Medical Research Council Project Grant (Grant Number 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurosciences. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

