Görsel Protez Araştırmaları için Retinal Nöronların Hesaplamalı Modellemesi - Temel Yaklaşımlar
Summary
Bir retinal nöronun elektriksel stimülasyona yanıt olarak davranışlarını hesaplamalı olarak modellemek için bir iş akışını özetliyoruz. Hesaplamalı model çok yönlüdür ve bir dizi fizyolojik senaryoyu simüle etmede ve gelecekteki in vivo / in vitro çalışmaların sonuçlarını tahmin etmede yararlı olan otomasyon adımlarını içerir.
Abstract
Hesaplamalı modelleme, in vivo ve in vitro sistemlerin davranışlarını tahmin etme kapasitesi nedeniyle sinir mühendisliğinde giderek daha önemli bir yöntem haline gelmiştir. Bu, fizyolojik sonuçların genellikle çok kesin bir tahminini sağlayarak belirli bir çalışmada gerekli olan hayvan sayısını en aza indirmenin temel avantajına sahiptir. Görsel protez alanında, hesaplamalı modelleme, implante edilebilir bir elektrot dizisinin tasarımının bilgilendirilmesi ve söz konusu diziden elektriksel uyarıların iletilmesiyle ortaya çıkabilecek görsel algıların tahmin edilmesi de dahil olmak üzere bir dizi pratik uygulamaya sahiptir. Literatürde açıklanan bazı modeller, elektrik alanını hesaplamak için üç boyutlu (3D) bir morfolojiyi ve ilgilenilen nöronun veya sinir ağının bir kablo modelini birleştirir. Bu iki adımlı yöntemin, hesaplamalı modellemede daha önce sınırlı deneyime sahip olabilecek araştırmacılara erişilebilirliğini artırmak için, hesaplamalı bir model oluşturmak ve bunu uygulanan stimülasyon protokollerinin fizyolojik ve psikofiziksel sonuçlarını tahmin etmede kullanmak için alınacak temel yaklaşımların bir videosunu sunuyoruz. görsel bir protez. Kılavuz, sonlu elemanlar modelleme (FEM) yazılımında bir 3B model oluşturma adımlarını, çok bölmeli bir nöron hesaplama yazılımında retinal ganglion hücre modelinin oluşturulmasını ve ardından ikisinin birleştirilmesini içerir. Fiziksel denklemleri sayısal olarak çözmek için sonlu elemanlar modelleme yazılımı, dokunun elektriksel uyarımlarındaki elektrik alan dağılımını çözmek için kullanılacaktır. Daha sonra, bir sinir hücresinin veya ağın elektriksel aktivitelerini simüle etmek için özel bir yazılım kullanıldı. Bu öğreticiyi takip etmek için, bir nöroprotezin çalışma prensibinin yanı sıra nörofizyolojik kavramlara (örneğin, aksiyon potansiyeli mekanizması ve Hodgkin-Huxley modelinin anlaşılması) aşina olmak gerekecektir.
Introduction
Görsel nöroprotezler, fosfenler veya ışığı görme hissi yaratmak için görsel yoldaki sinir hücrelerine stimülasyonlar (elektrik, ışık vb.) ileten bir grup cihazdır. Dejeneratif retina hastalıklarının neden olduğu kalıcı körlüğü olan kişiler için neredeyse on yıldır klinik kullanımda olan bir tedavi stratejisidir. Tipik olarak, eksiksiz bir sistem, kullanıcının etrafındaki görsel bilgileri yakalayan harici bir kamera, görüntüyü işlemek ve bir dizi elektrik darbesine çevirmek için bir güç kaynağı ve bilgi işlem ünitesi ve sinir dokusunu birbirine bağlayan ve elektrik darbelerini sinir hücrelerine ileten implante edilmiş bir elektrot dizisi içerecektir. Çalışma prensibi, görsel bir nöroprotezin, hasarlı dokudan aşağı doğru olduğu sürece, retinadan görsel kortekse giden görsel yol boyunca farklı bölgelere yerleştirilmesine izin verir. Görsel nöroprotezlerdeki mevcut araştırmaların çoğu, stimülasyonun etkinliğini arttırmaya ve daha doğal bir görüş sağlamak için mekansal keskinliği geliştirmeye odaklanmaktadır.
Stimülasyonun etkinliğini artırma çabalarında, hesaplamalı modelleme, bir protez tasarımını doğrulamak ve görsel sonucunu simüle etmek için maliyet ve zaman etkili bir yöntem olmuştur. Bu alandaki hesaplamalı modelleme, Greenberg 1’in retinal ganglion hücresinin hücre dışı elektriksel uyaranlara tepkisini modellediği için 1999’dan beri popülerlik kazanmıştır. O zamandan beri, elektrik darbesi 2,3’ün parametrelerini veya elektrot 4,5’in geometrik tasarımını optimize etmek için hesaplamalı modelleme kullanılmıştır. Karmaşıklık ve araştırma sorularındaki çeşitliliğe rağmen, bu modeller ortamdaki (örneğin, sinir dokusu) elektrik voltajı dağılımını belirleyerek ve çevredeki nöronların elektrik voltajı nedeniyle üreteceği elektriksel tepkiyi tahmin ederek çalışır.
Bir iletkendeki elektriksel gerilim dağılımı, Poisson denklemleri6’nın tüm konumlarda çözülmesiyle bulunabilir:
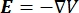
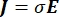
burada E elektrik alanı, V elektrik potansiyeli, J akım yoğunluğu ve σ elektrik iletkenliğidir. Denklemdeki 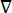 bir gradyan işlecini gösterir. Sabit akım durumunda, modele aşağıdaki sınır koşulları uygulanır:
bir gradyan işlecini gösterir. Sabit akım durumunda, modele aşağıdaki sınır koşulları uygulanır:
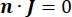
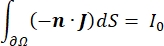
burada n , yüzeyin normalidir, Ω sınırı temsil eder ve I0 , belirli akımı temsil eder. Birlikte, dış sınırlarda elektrik yalıtımı oluştururlar ve seçilen bir sınır için bir akım kaynağı oluştururlar. İzotropik iletkenliğe sahip homojen bir ortamda bir monopolar nokta kaynağı varsayarsak, keyfi bir konumdaki hücre dışı elektrik potansiyeli7 ile hesaplanabilir:
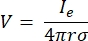
burada Ie akımdır ve elektrot ile ölçüm noktası arasındaki mesafedir. Ortam homojen değilse veya anizotropik olduğunda veya elektrot dizisi birden fazla elektrota sahipse, denklemleri sayısal olarak çözmek için bir hesaplama paketi uygun olabilir. Sonlu elemanlar modelleme yazılımı6 , hacim iletkenini ‘elemanlar’ olarak bilinen küçük bölümlere ayırır. Elementler birbirleriyle bağlantılıdır, öyle ki bir elementteki değişimin etkileri diğerlerindeki değişimi etkiler ve bu elementleri tanımlamaya yarayan fiziksel denklemleri çözer. Modern bilgisayarların artan hesaplama hızıyla, bu işlem saniyeler içinde tamamlanabilir. Elektrik potansiyeli hesaplandıktan sonra, nöronun elektriksel tepkisi tahmin edilebilir.
Bir nöron, elektrik sinyalleri şeklinde bilgi gönderir ve alır. Bu tür sinyaller iki şekilde gelir – derecelendirilmiş potansiyeller ve eylem potansiyelleri. Derecelendirilmiş potansiyeller, membran boyunca voltajın daha pozitif (depolarizasyon) veya negatif (hiperpolarizasyon) hale geldiği membran potansiyelindeki geçici değişikliklerdir. Derecelendirilmiş potansiyellerin tipik olarak lokalize etkileri vardır. Onları üreten hücrelerde, aksiyon potansiyelleri, bir aksonun uzunluğu boyunca uzun mesafeler kat edebilen ya hep ya hiç tepkileridir. Hem derecelendirilmiş hem de aksiyon potansiyelleri, elektriksel ve kimyasal ortama duyarlıdır. Bir aksiyon potansiyeli artışı, bir eşik transmembran potansiyeli aşıldığında, retinal ganglion hücreleri de dahil olmak üzere çeşitli nöronal hücre tipleri tarafından üretilebilir. Aksiyon potansiyeli yükselme ve yayılma daha sonra sinyallerin aşağı akış nöronlarına sinaptik iletimini tetikler. Bir nöron, silindirik segmentlere bölünmüş bir kablo olarak modellenebilir, burada her segment, lipit çift katmanlı membran8 nedeniyle kapasitans ve dirence sahiptir. Bir nöron hesaplama programı9 , hücreyi birden fazla bölmeye ayırarak ve matematiksel model10’u çözerek elektriksel olarak uyarılabilir bir hücrenin elektriksel aktivitesini tahmin edebilir:
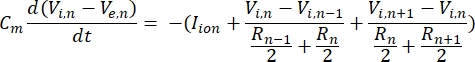
Bu denklemde, Cmmembran kapasitansıdır, V e,n n düğümündeki hücre dışı potansiyeldir, Vi,n düğümdeki hücre içi potansiyel, Rndüğümdeki hücre içi (uzunlamasına direnç) dirençtir ve Iiyonu, n düğümündeki iyon kanallarından geçen iyonik akımdır. FEM modelinden V değerleri, stimülasyon aktif olduğunda nörondaki tüm düğümler için Ve,n olarak uygulanır.
İyon kanallarından gelen transmembran akımları, Hodgkin-Huxley formülasyonları11 kullanılarak modellenebilir:
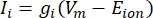
burada g i kanalın spesifik iletkenliği, V m transmembran potansiyeli (V i,n – Ve,n) ve Eiyonu iyon kanalının tersine çevirme potansiyelidir. Na kanalı gibi gerilim kapılı kanallar için, kanalların açılma veya kapanma olasılığını tanımlayan boyutsuz parametreler, m ve h tanıtılır:
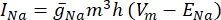
burada belirli iyon kanalı için maksimum membran iletkenliği ve 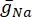 m ve h parametrelerinin değerleri diferansiyel denklemlerle tanımlanır:
m ve h parametrelerinin değerleri diferansiyel denklemlerle tanımlanır:
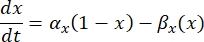
burada x ve x α β, iyon kanalının hız sabitlerini tanımlayan voltaja bağlı fonksiyonlardır. Genellikle şu şekli alırlar:
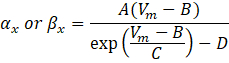
Maksimum iletkenlik de dahil olmak üzere bu denklemlerdeki parametrelerin değerleri ve A, B, C ve D sabitleri tipik olarak ampirik ölçümlerden bulunmuştur.
Bu yapı taşlarıyla, açıklanan adımlar izlenerek farklı karmaşıklıklara sahip modeller oluşturulabilir. Bir FEM yazılımı, Poisson denklemi analitik olarak çözülemediğinde, örneğin hacim iletkeninde homojen olmayan veya anizotropik iletkenlik durumunda veya elektrot dizisinin geometrisi karmaşık olduğunda kullanışlıdır. Hücre dışı potansiyel değerler çözüldükten sonra, nöron kablosu modeli daha sonra nöron hesaplama yazılımında sayısal olarak çözülebilir. İki yazılımı birleştirmek, karmaşık bir nöron hücresinin veya ağının düzgün olmayan bir elektrik alanına hesaplanmasını sağlar.
Suprakoroidal stimülasyon altında retinal ganglion hücresinin iki aşamalı basit bir modeli, yukarıda belirtilen programlar kullanılarak oluşturulacaktır. Bu çalışmada, retinal ganglion hücresi bir dizi elektriksel akım darbesine maruz bırakılacaktır. Hücrenin uyarana göre konumu da mesafe-eşik ilişkisini göstermek için değişir. Ayrıca, çalışma, hesaplama sonucunun, farklı boyutlarda stimülasyon elektrodu12 kullanılarak kortikal aktivasyon eşiğinin in vivo çalışmasına karşı doğrulanmasının yanı sıra, elektrot-nöron mesafesi ile aktivasyon eşiği13 arasındaki ilişkiyi gösteren bir in vitro çalışmayı da içermektedir.
Protocol
Representative Results
Discussion
Bu yazıda, sonlu elemanlar ve biyofiziksel nöron modellemesini birleştiren bir modelleme iş akışı gösterdik. Model, karmaşıklığında farklı amaçlara uyacak şekilde değiştirilebildiği için oldukça esnektir ve sonuçları ampirik bulgulara karşı doğrulamanın bir yolunu sağlar. Ayrıca, otomasyonu etkinleştirmek için modeli nasıl parametrelendirdiğimizi de gösterdik.
İki aşamalı modelleme yöntemi, hücre dışı bir stimülasyon varlığında nöronun kablo denkl…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu araştırma Ulusal Sağlık ve Tıbbi Araştırma Konseyi Proje Hibe (Hibe Numarası 1109056) tarafından finanse edilmektedir.
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurosciences. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

