Microfluïdische hulpmiddelen voor het onderzoeken van schimmel-microbiële interacties op cellulair niveau
Summary
Vanwege de ondoorzichtigheid van de bodem kunnen interacties tussen de samenstellende microben niet gemakkelijk worden gevisualiseerd met cellulaire resolutie. Hier worden twee microfluïdische hulpmiddelen gepresenteerd, die nieuwe mogelijkheden bieden voor het onderzoeken van schimmel-microbiële interacties. De apparaten zijn veelzijdig en eenvoudig te gebruiken, waardoor hoge spatiotemporale controle en beeldvorming met hoge resolutie op cellulair niveau mogelijk is.
Abstract
Filamenteuze schimmels zijn succesvolle bewoners van de bodem en spelen een belangrijke rol in bodemecosystemen, zoals bij de afbraak van organische en anorganische stoffen, evenals de regulering van nutriëntenniveaus. Daar vinden ze ook tal van mogelijkheden om te communiceren met een verscheidenheid aan andere microben zoals bacteriën of andere schimmels. Het bestuderen van schimmelinteracties op cellulair niveau kan echter een uitdaging zijn vanwege de black box-achtige aard van de bodem. Nieuwe microfluïdische hulpmiddelen worden ontwikkeld voor de studie van schimmelinteracties; twee platforms die zijn ontworpen om bacteriële-schimmel- en schimmel-schimmelinteracties te bestuderen, worden benadrukt. Binnen deze microkanalen kunnen schimmel-microbiële interacties worden gemonitord in gecontroleerde fysisch-chemische omgevingen met een hogere temporele en ruimtelijke resolutie dan voorheen mogelijk was. Toepassing van deze hulpmiddelen heeft tal van nieuwe biologische inzichten opgeleverd, zoals de observatie van bacteriële polaire aanhechting aan schimmeldraden of het onthullen van niet-gekarakteriseerde schimmel-schimmelantagonismen. Een belangrijk kenmerk van deze methodologieën betreft het gebruiksgemak van deze tool door niet-experts, wat zeer vertaalbare technologieën oplevert voor gebruik in microbiologische laboratoria.
Introduction
De bodem is een uitzonderlijk diverse omgeving met een overvloed aan micro-organismen die een belangrijke rol spelen voor koolstof- en fosforcycli 1,2. Filamenteuze schimmels zijn een belangrijk onderdeel van talrijke ecosystemen als afbrekers van organische en anorganische materie en kunnen de voeding van planten verbeteren door de vorming van symbiotische relaties 3,4. In de bodem interageren schimmels dynamisch met een veelheid aan microben zoals andere schimmels5, bacteriën6, virussen7 en nematoden8. Deze interacties hebben aanzienlijke gevolgen voor de bodem- en plantgezondheid. Maar als gevolg van een gebrek aan geschikte experimentele systemen die in staat zijn om interagerende micro-organismen met hoge resolutie in beeld te brengen, blijven velen ongedefinieerd.
Onderzoeken met betrekking tot bacteriële-schimmelinteracties (BFI’s) en schimmel-schimmelinteracties (FFI’s) hebben waardevolle toepassingen op verschillende gebieden, waaronder antimicrobiële stoffen in de geneeskunde en biologische bestrijders in de landbouw. De schimmel Coprinopsis cinerea produceert bijvoorbeeld het peptide copsine, waarvan is aangetoond dat het antibacteriële activiteit vertoont tegen de menselijke ziekteverwekker Listeria monocytogenes9. Evenzo wordt de van schimmel afgeleide verbinding, griseofulvine, veel gebruikt als behandeling voor menselijke schimmelinfecties en is bovendien in staat om de groei van de plantpathogene schimmel Alternaria solani10,11 te remmen. Verschillende stammen van de bodembewonende bacterie Bacillus subtilis zijn ook effectieve biocontrolemiddelen gebleken van de schimmelplantpathogeen Rhizoctonia solani12,13. Niettemin, als gevolg van beperkingen in verband met traditionele methodologieën, worden BFI’s en FFI’s slecht begrepen op het niveau van enkele cellen.
Conventionele studies onderzoeken meestal BFI’s en FFI’s op macroschaal met behulp van agarplaten met twee of meer soorten in confrontatie. Hun interactie wordt beoordeeld door het meten van groeisnelheden en metabolietproductie van de confronterende soort 14,15,16; deze methodologie wordt echter alleen opgelost tot op kolonieniveau. Om interacties op cellulair niveau te bestuderen, kunnen bacteriële en schimmelinoculanten worden gekweekt op glazen microscoopglaasjes bedekt met agar die vervolgens worden afgebeeld onder een microscoop17. Niettemin kan het moeilijk zijn om een enkele hypha te volgen met behulp van microscoopglaasjes vanwege een gebrek aan opsluiting, wat betekent dat time-lapse-beelden moeilijker te verkrijgen zijn. Verder is de mogelijkheid om andere micro-organismen ruimtelijk op te sluiten binnen gedefinieerde gebieden van het schimmelmycelium of gedefinieerde chemische omgevingen te creëren die bijvoorbeeld kunnen worden verstoord, niet mogelijk in dergelijke opstellingen. De “black box” aard van de bodem draagt ook bij aan de complexiteit van het bestuderen van schimmel-microbiële interacties op het niveau van enkele cellen18. Door interagerende soorten te observeren, weg van de ongelooflijke diversiteit van het bodemmicrobioom, kan de exacte manier waarop individuele leden met elkaar omgaan worden beoordeeld. Er is dus een voortdurende behoefte aan veelzijdige platforms die hoge-resolutie, single-cell imaging van BFI’s en FFI’s mogelijk maken.
Microfluïdische technologieën, zogenaamde lab-on-a-chip-systemen, bieden een ideaal platform voor de studie van BFI’s en FFI’s op het niveau van enkele cellen. Het gebied van microfluïdica, afkomstig van technologieën die zijn ontwikkeld voor chemische analyse en micro-elektronica, is overgenomen door de biologische wetenschappen19. Microfluïdische technologieën reguleren kleine hoeveelheden vloeistoffen binnen een op maat gemaakt netwerk van geminiaturiseerde kanalen, met ten minste één dimensie op micrometerschaal, en hun gebruik in biologisch onderzoek breidt zich uit20. In het bijzonder zijn microfluïdische apparaten ontwikkeld om de groei van filamenteuze schimmels 21,22,23,24,25,26,27,28,29,30 te onderzoeken. Een voordeel van het gebruik van deze technologie is dat de opsluiting van schimmeldraden en de verdeling van voedingsstoffen in microkanalen meer lijkt op de structuur van het bodemmilieu dan conventionele agarmethoden31. Onlangs zijn microfluïdische platforms gebruikt om interacties tussen menselijke neutrofielen en schimmelpathogenen32, bacteriën en plantenwortels33, evenals schimmels en nematoden34,35 te onderzoeken.
Een van de vele voordelen van het gebruik van microfluïdica voor het bestuderen van microbiële interacties omvat de specifieke controle van de microkanaalomgeving. Laminaire stromingsregimes kunnen bijvoorbeeld worden gebruikt om gedefinieerde concentratiegradiënten te genereren, wat vooral handig is bij het onderzoeken van bacteriële chemotaxis36. Een ander voordeel is dat de transparante aard van poly (dimethylsiloxaan) (PDMS), een goedkoop, biocompatibel elastomeerpolymeer dat vaak wordt gebruikt bij de vervaardiging van microfluïdische apparaten, beeldvorming met hoge resolutie van afzonderlijke cellen met behulp van brightfield- en fluorescentiemicroscopiemogelijk maakt 37. Evenzo betekent de opsluiting van microben in microkanalen dat time-lapse-experimenten kunnen worden uitgevoerd die afzonderlijke cellen volgen, waardoor individuele cellulaire reacties kunnen worden geregistreerd en gekwantificeerd37. Ten slotte, aangezien microfluïdische apparaten kunnen worden ontworpen om gebruiksvriendelijk te zijn, kunnen ze gemakkelijk worden gebruikt door niet-experts38.
Het bevorderen van de kennis van de interacties tussen bodembewonende micro-organismen is belangrijk voor het verbeteren van duurzame ecosysteembeheerpraktijken die de biodiversiteit in stand houden en om de gevolgen van klimaatverandering voor terrestrische milieus te beperken39. De ontwikkeling van nieuwe microfluïdische hulpmiddelen is dus van fundamenteel belang om het begrip van schimmels en hun interacties op cellulair niveau uit te breiden. Het protocol hier zal zich richten op twee microfluïdische apparaten die zijn geproduceerd voor de studie van BFI’s40 en FFI’s41 zoals weergegeven in figuur 1.
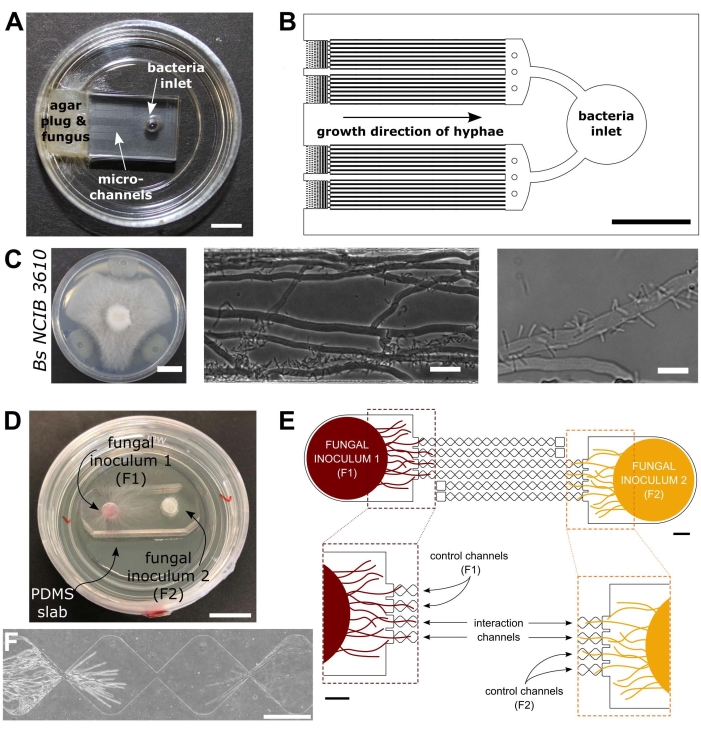
Figuur 1: Visuele en schematische weergave van de bacteriële-schimmelinteractie (BFI) en schimmel-schimmelinteractie (FFI) apparaten. (A) Afbeelding van het BFI-apparaat. Een myceliale plug wordt geplaatst bij de ingang van het ene uiteinde van de microkanalen om hyphale groei in het apparaat mogelijk te maken. De bacteriële inlaat bevindt zich aan de andere kant. Schaalbalk = 5 mm. (B) Schematisch overzicht van het BFI-apparaat, met de positionering van de bacteriële inlaten en de richting van de hyphale groei door de interactiemicrokanalen. De kanalen zijn 10 μm diep, 100 μm breed en 7 mm lang, met in totaal 28 observatiekanalen. (C) Confrontatietest op agarplaat tussen Coprinopsis cinerea en Bacillus subtilis NCIB 3610, schaalbalk = 20 mm (links). Microscopiebeelden die de interactie tonen tussen C. cinerea en B. subtilis NCIB 3610 binnen het microkanaal (midden en rechts), d.w.z. polaire aanhechting van bacteriën aan schimmeldraden. Schaalbalk = 25 μm (midden) en 10 μm (rechts). (D) Afbeelding van het FFI-apparaat dat is verbonden met een petrischaal met glazen bodem, dubbel ingeënt met myceliale pluggen. Schaalbalk = 1 cm. (E) Schematisch overzicht van het FFI-apparaat. Twee schimmelinoculante pluggen worden in de inlaten aan beide uiteinden van het apparaat gebracht, waardoor hyphale exploratie van de microkanalen mogelijk is. Controlekanalen zijn slechts verbonden met één schimmelinlaat en hebben een doodlopend kanaal, waardoor interacties tussen de testschimmels worden voorkomen. Interactiekanalen verbinden beide schimmelinlaten en maken hyphale interacties tussen de proefpersonen in het microkanaal mogelijk. Elk interactiekanaal bestaat uit 18 diamantvormige secties, met een totale lengte van 8,8 mm (490 x 430 μm per diamant), 10 μm diep en met een verbindingsgebied tussen elke diamant van 20 μm. Kanaaltypen worden gedupliceerd, schaalbalken = 1 mm. (F) Interactiezone tussen twee naderende hyphale fronten, groeiend uit tegenovergestelde uiteinden van het onderling verbonden interactiekanaal. Fasecontrastmicroscopiebeeld, schaalbalk = 250 μm. De panelen in deze figuur zijn aangepast van Stanley et al., 2014 (A-C)40 en Gimeno et al., 2021 (D-F)41. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Dit artikel presenteert een protocol voor de studie van schimmel-microbiële interacties met behulp van kanaalmicrofluïdica. De auteurs willen de veelzijdigheid van deze apparaten aantonen en aanpassing aanmoedigen om aan de interesses van de onderzoeker te voldoen. Met behulp van de voorbeeld BFI- en FFI-apparaten kunnen schimmel-microbiële interacties in meer detail worden bestudeerd dan voorheen toegankelijk was. Door de achtergrondcomplexiteit en heterogeniteit van de bodem te verwijderen, de groei van schimmeldrad…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We erkennen financiële steun van het Department of Bioengineering van Imperial College London en The Leverhulme Trust (Research Grant Reference: RPG-2020-352).
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
References
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

