Mikrofluidiske verktøy for probing av sopp-mikrobielle interaksjoner på cellenivå
Summary
På grunn av jordens opasitet kan interaksjoner mellom dens bestanddeler ikke lett visualiseres med cellulær oppløsning. Her presenteres to mikrofluidiske verktøy, som gir nye muligheter for å undersøke sopp-mikrobielle interaksjoner. Enhetene er allsidige og enkle å bruke, noe som muliggjør høy romlig kontroll og høyoppløselig bildebehandling på mobilnivå.
Abstract
Filamentøse sopp er vellykkede innbyggere i jord og spiller en viktig rolle i jordøkosystemer, som i nedbrytning av organisk og uorganisk materiale, samt regulering av næringsnivåer. Der finner de også mange muligheter til å samhandle med en rekke andre mikrober som bakterier eller andre sopp. Å studere soppinteraksjoner på cellenivå kan imidlertid være utfordrende på grunn av jordens svarte bokslignende natur. Nye mikrofluidiske verktøy utvikles for studiet av soppinteraksjoner; to plattformer designet for å studere bakteriell-sopp og sopp-sopp interaksjoner er fremhevet. Innenfor disse mikrokanalene kan sopp-mikrobielle interaksjoner overvåkes i kontrollerte fysisk-kjemiske miljøer med høyere temporal og romlig oppløsning enn tidligere mulig. Anvendelsen av disse verktøyene har gitt en rekke nye biologiske innsikter, for eksempel observasjon av bakteriell polar tilknytning til hyphae eller avsløre ukarakteriserte sopp-sopp antagonismer. Et sentralt trekk ved disse metodene anser brukervennligheten av dette verktøyet av ikke-eksperter, noe som gir svært overførbare teknologier for bruk i mikrobiologilaboratorier.
Introduction
Jord er et eksepsjonelt mangfoldig miljø som inneholder en overflod av mikroorganismer som er medvirkende til karbon- og fosforsykluser 1,2. Filamentøse sopp er en viktig komponent i mange økosystemer som nedbrytere av organisk og uorganisk materiale og kan forbedre ernæringen av planter gjennom dannelsen av symbiotiske forhold 3,4. Innenfor jord samhandler sopp dynamisk med en rekke mikrober som andre sopp5, bakterier6, virus7 og nematoder8. Disse interaksjonene har betydelige konsekvenser for jord- og plantehelsen. Likevel, på grunn av mangel på passende eksperimentelle systemer som er i stand til å avbilde interagerende mikroorganismer med høy oppløsning, forblir mange udefinerte.
Undersøkelser om bakteriell-sopp interaksjoner (BFF) og sopp-sopp interaksjoner (FFIer) har verdifulle anvendelser på en rekke felt, inkludert antimikrobielle midler i medisin og biologiske kontrollmidler i landbruket. For eksempel produserer sopp coprinopsis cinerea peptid copsin, som har vist seg å vise antibakteriell aktivitet mot det menneskelige patogenet Listeria monocytogenes9. På samme måte er den soppavledede forbindelsen, griseofulvin, mye brukt som behandling for menneskelige soppinfeksjoner og er i tillegg i stand til å hemme veksten av planten patogen sopp Alternaria solani10,11. Flere stammer av jordboende bakterie Bacillus subtilis har også vist seg å være effektive biokontrollmidler av soppplantepatogenet Rhizoctonia solani12,13. Likevel, på grunn av begrensninger knyttet til tradisjonelle metoder, er BBFIer og FFIer dårlig forstått på nivået av enkeltceller.
Konvensjonelle studier utforsker vanligvis BBFIer og FFIer på makroskalaen ved hjelp av agarplater med to eller flere arter i konfrontasjon. Deres interaksjon vurderes ved å måle vekstrater og metabolittproduksjon av de konfronterende artene 14,15,16; Denne metodikken løses imidlertid bare til koloninivå. For å studere interaksjoner på cellenivå, kan bakterielle og soppinokulanter dyrkes på glassmikroskopsklier belagt med agar som deretter avbildes under et mikroskop17. Likevel kan det være vanskelig å følge en enkelt hypha ved hjelp av mikroskoplysbilder på grunn av mangel på innesperring, noe som betyr at tidsforløpbilder er vanskeligere å få tak i. Videre er muligheten til å romlig begrense andre mikroorganismer innenfor definerte regioner i soppmiceliet eller skape definerte kjemiske miljøer som for eksempel kan bli forstyrret, ikke mulig i slike oppsett. Jordens “black box” natur legger også til kompleksiteten ved å studere sopp-mikrobielle interaksjoner på nivået av enkeltceller18. Ved å observere interagerende arter vekk fra det utrolige mangfoldet i jordmikrobiomet, kan den nøyaktige måten individuelle medlemmer samhandler på vurderes. Dermed er det et fortsatt behov for allsidige plattformer som muliggjør høyoppløselig, encellet bildebehandling av BFFIer og FFIer.
Mikrofluidisk teknologi, såkalte lab-on-a-chip-systemer, gir en ideell plattform for studiet av BFF-er og FFIer på nivået av enkeltceller. Feltet mikrofluidikk, med opprinnelse fra teknologier utviklet for kjemisk analyse og mikroelektronikk, er vedtatt av biovitenskapene19. Mikrofluidiske teknologier regulerer små mengder væsker i et skreddersydd nettverk av miniatyriserte kanaler, har minst en dimensjon på mikrometreskalaen, og bruken i biologisk forskning utvides20. Spesielt er mikrofluidiske enheter utviklet for å undersøke veksten av filamentøse sopp 21,22,23,24,25,26,27,28,29,30. En fordel med å bruke denne teknologien er at innesperring av hyphae og fordelingen av næringsstoffer i mikrokanal ligner mer på jordens struktur enn konvensjonelle agarmetoder31. Nylig har mikrofluidiske plattformer blitt brukt til å undersøke interaksjoner mellom menneskelige nøytrofiler og sopppatogener32, bakterier og planterøtter33, samt sopp og nematoder34,35.
En av de mange fordelene ved å bruke mikrofluidikk for å studere mikrobielle interaksjoner inkluderer den spesifikke kontrollen av mikrokanalmiljøet. For eksempel kan laminære strømningsregimer utnyttes for å generere definerte konsentrasjonsgradienter, noe som er spesielt nyttig når du undersøker bakteriell chemotaxis36. En annen fordel er at den gjennomsiktige naturen til poly (dimetylsiloksan) (PDMS), en billig, biokompatibel elastomerisk polymer som vanligvis brukes til fremstilling av mikrofluidiske enheter, letter høyoppløselig avbildning av enkeltceller ved hjelp av brightfield og fluorescensmikroskopi37. På samme måte betyr innesperring av mikrober i mikrokanal at tidsforløpeksperimenter som sporer enkeltceller, kan utføres, slik at individuelle cellulære responser kan registreres og kvantifiseres37. Til slutt, da mikrofluidiske enheter kan utformes for å være brukervennlige, kan de enkelt brukes av ikke-eksperter38.
Videre kunnskap om samspillet mellom jordboende mikroorganismer er viktig for å forbedre bærekraftige økosystemforvaltningspraksiser som opprettholder biologisk mangfold og for å redusere virkningen av klimaendringer på terrestriske miljøer39. Dermed er utviklingen av nye mikrofluidiske verktøy grunnleggende for å utvide forståelsen av sopp og deres interaksjoner på cellenivå. Protokollen her vil fokusere på to mikrofluidiske enheter produsert for studiet av BFIer40 og FFIer41 som representert i figur 1.
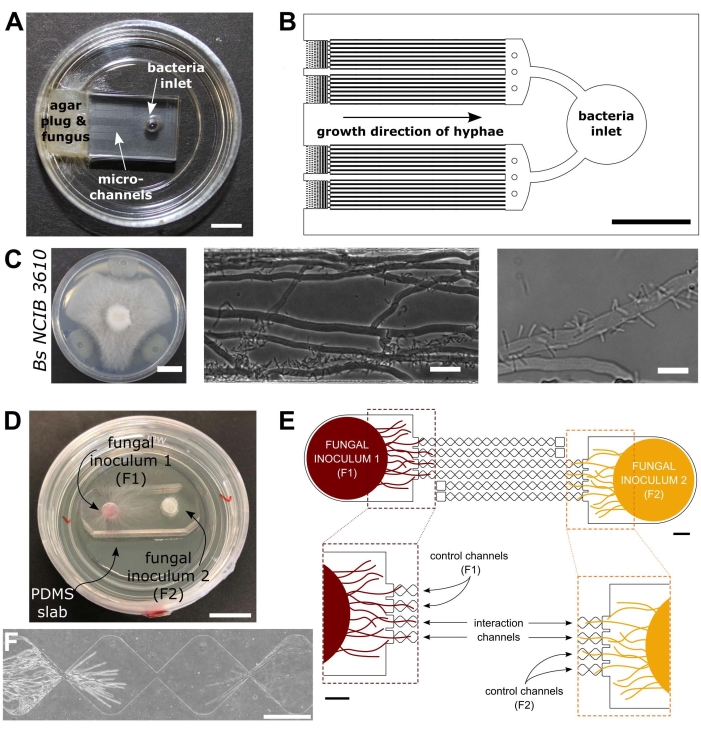
Figur 1: Visuell og skjematisk fremstilling av bakteriell soppinteraksjon (BFI) og sopp-soppinteraksjonsenheter (FFI). (A) Bilde av BFI-enheten. En mycelial plugg er plassert ved inngangen til den ene enden av mikrokanalene for å tillate hyphalvekst i enheten. Bakterieinntaket er i motsatt ende. Skalastang = 5 mm. (B) Skjematisk oversikt over BFI-enheten, som viser plasseringen av bakterieinntakene og retningen av hyphalvekst gjennom interaksjonsmikrokanalene. Kanalene er 10 μm i dybden, 100 μm brede og 7 mm lange, med totalt 28 observasjonskanaler. (C) Konfrontasjonsanalyse på agarplate mellom Coprinopsis sinerea og Bacillus subtilis NCIB 3610, skala bar = 20 mm (venstre). Mikroskopibilder som viser samspillet mellom C. cinerea og B. subtilis NCIB 3610 innenfor mikrokanal (midten og høyre), det vil si polar festing av bakterier til sopphyphae. Skalastang = 25 μm (midten) og 10 μm (høyre). (D) Bilde av FFI-enheten festet til en glassbunnet Petri-tallerken, dobbelt inokulert med mycelialplugger. Skalastang = 1 cm. (E) Skjematisk oversikt over FFI-enheten. To soppinokulantplugger blir introdusert i innløpene i hver ende av enheten, slik at hyphalutforskning av mikrokanalene tillater hyphalutforskning av mikrokanalene. Kontrollkanaler er kun koblet til ett soppinntak og har en blind kanal, noe som forhindrer interaksjoner mellom testsvampene. Interaksjonskanaler forbinder både soppinntak og tillater hyphalinteraksjoner mellom testpersonene i mikrokanal. Hver interaksjonskanal består av 18 diamantformede seksjoner, som måler en total lengde på 8,8 mm (490 x 430 μm per diamant), 10 μm dyp og har en forbindelsesregion mellom hver diamant på 20 μm. Kanaltyper dupliseres, skalastenger = 1 mm. (F) Interaksjonssone mellom to nærliggende hyphalfronter, som vokser fra motsatte ender av den sammenkoblede samhandlingskanalen. Fasekontrastmikroskopibilde, skalalinje = 250 μm. Panelene i denne figuren er modifisert fra Stanley et al., 2014 (A-C)40 og Gimeno et al., 2021 (D-F)41. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Denne artikkelen presenterer en protokoll for studiet av sopp-mikrobielle interaksjoner ved hjelp av kanalmikrofluidikk. Forfatterne tar sikte på å demonstrere allsidigheten til disse enhetene og oppmuntre til tilpasning som passer forskerens interesser. Ved hjelp av de eksemplariske BFI- og FFI-enhetene kan soppmikrobielle interaksjoner studeres mer detaljert enn tidligere tilgjengelig. Ved å fjerne jordens bakgrunnskompleksitet og heterogenitet, moderere veksten av hyphae slik at de er begrenset til en enkelt monola…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi anerkjenner økonomisk støtte fra Institutt for bioingeniør ved Imperial College London og The Leverhulme Trust (Research Grant Reference: RPG-2020-352).
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
References
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

