En veiledning for å undersøke intramuskulær fettdannelse og dens cellulære opprinnelse i skjelettmuskulatur
Summary
Erstatning av sunt muskelvev med intramuskulært fett er et fremtredende trekk ved menneskelige sykdommer og tilstander. Denne protokollen skisserer hvordan man visualiserer, avbilder og kvantifiserer intramuskulært fett, slik at man kan studere mekanismene som ligger til grunn for intramuskulær fettdannelse.
Abstract
Fibro-adipogenic progenitors (FAPs) er mesenkymale stromale celler som spiller en avgjørende rolle under skjelettmuskulaturhomeostase og regenerering. FAPs bygger og vedlikeholder den ekstracellulære matrisen som fungerer som et molekylært myofiber stillas. I tillegg er FAPs uunnværlige for myofiberregenerering, da de utskiller en rekke gunstige faktorer som registreres av muskelstamceller (MuSC). I syke tilstander er FAPs imidlertid den cellulære opprinnelsen til intramuskulært fett og fibrotisk arrvev. Denne fettfibrosen er et kjennetegn på sarkopeni og nevromuskulære sykdommer, som Duchenne muskeldystrofi. En betydelig barriere for å bestemme hvorfor og hvordan FAPs differensierer i intramuskulært fett er effektiv bevaring og påfølgende visualisering av adipocytter, spesielt i frosne vevsseksjoner. Konvensjonelle metoder for behandling av skjelettmuskulaturvev, for eksempel snap-frysing, bevarer ikke morfologien til individuelle adipocytter på riktig måte, og forhindrer dermed nøyaktig visualisering og kvantifisering. For å overvinne denne hindringen ble det utviklet en streng protokoll som bevarer adipocyttmorfologi i skjelettmuskelseksjoner som tillater visualisering, avbildning og kvantifisering av intramuskulært fett. Protokollen skisserer også hvordan man behandler en del av muskelvev for RT-qPCR, slik at brukerne kan bekrefte observerte endringer i fettdannelse ved å se forskjeller i uttrykket av adipogene gener. I tillegg kan den tilpasses for å visualisere adipocytter ved helmontert immunfluorescens av muskelprøver. Til slutt skisserer denne protokollen hvordan man utfører genetisk avstamningssporing av Pdgfrα-uttrykkende FAPs for å studere den adipogene konverteringen av FAPs. Denne protokollen gir konsekvent høyoppløselige og morfologisk nøyaktige immunfluorescerende bilder av adipocytter, sammen med bekreftelse av RT-qPCR, noe som muliggjør robust, streng og reproduserbar visualisering og kvantifisering av intramuskulært fett. Sammen er analyserørledningen beskrevet her det første skrittet for å forbedre vår forståelse av hvordan FAPs skiller seg ut i intramuskulært fett, og gir et rammeverk for å validere nye inngrep for å forhindre fettdannelse.
Introduction
Infiltrasjon av sunt muskelvev med fettfibrose er et fremtredende trekk ved Duchenne muskeldystrofi (DMD) og andre nevromuskulære sykdommer, samt sarkopeni, fedme og diabetes 1,2,3,4,5,6,7,8,9,10 . Selv om økt fettinfiltrasjon under disse forholdene er sterkt forbundet med redusert muskelfunksjon, er vår kunnskap om hvorfor og hvordan intramuskulære fettformer fortsatt er begrenset. FAPs er en multipotent mesenkymal stromal cellepopulasjon tilstede i de fleste voksne organer, inkludert skjelettmuskulatur11,12. Med alderen og i kroniske sykdommer produserer FAPs imidlertid fibrotisk arrvev og skiller seg ut i adipocytter, som ligger mellom individuelle myofibre og danner intramuskulært fett 13,14,15,16,17,18,19,20.
For å begynne å bekjempe intramuskulær fettdannelse, må mekanismene for hvordan FAPs blir til adipocytter defineres. PDGFRα er “gullstandard” -markøren i feltet for å identifisere FAPs i muskelen til flere arter 13,16,17,18,20,21,22,23,24,25,26,27. Som et resultat har flere murine tamoxifen-induserbare Cre-linjer, under kontroll av Pdgfrα-promotoren, blitt generert, noe som muliggjør genetisk manipulerende FAPs in vivo ved bruk av Cre-LoxP-systemet 27,28,29. For eksempel, ved å kombinere denne induserbare Cre-linjen med en genetisk reporter, kan avstamningssporing av FAPs utføres, en strategi vi med hell har brukt på skjebnekart FAPs i muskel og hvitt fettvev20,30. Foruten avstamningssporing, gir disse Cre-linjene verdifulle verktøy for å studere FAP-til-fett-konvertering.
Et stort hinder for å definere mekanismen for den adipogene omdannelsen av FAPs til intramuskulært fett er evnen til å strengt og reproduserbart kvantifisere mengden intramuskulært fett som har dannet seg under forskjellige forhold. Nøkkelen er å balansere bevaring av muskel- og fettvev og matche dette med de tilgjengelige fargemetodene for å visualisere adipocytter. For eksempel er skjelettmuskulatur ofte snapfrosset uten forutgående fiksering, noe som bevarer myofibre, men forstyrrer adipocyttmorfologien (figur 1). I motsetning til dette fjerner fiksering etterfulgt av parafininnbygging, mens du viser den beste vevshistologien, inkludert adipocytter, alle lipider, og gjør dermed de fleste lipofile fargestoffer, som det ofte brukte fargestoffet Oil Red O, ubrukelig.
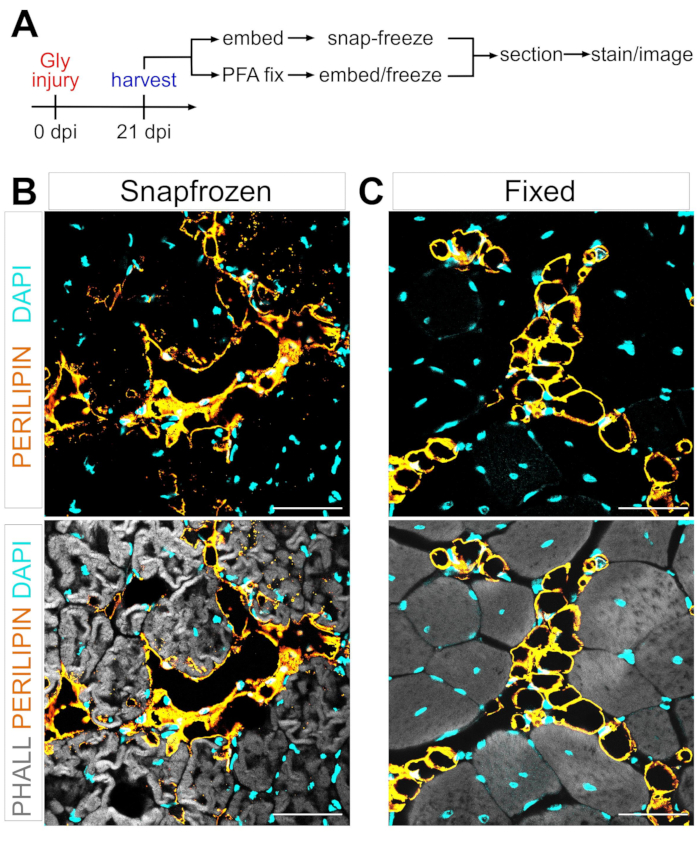
Figur 1: Representative bilder av intramuskulært fett i snap-frozen versus fixed muscle tissue. (A) Skjematisk oversikt over eksperimentoppsettet. Immunfluorescerende bilder som viser adipocytter (gul), myofibre (grå) og kjerner (cyan) innenfor både (B) snapfrosne og (C) faste TAer 21 dager etter glyserolskade. Skalafelt: 50 μm. Klikk her for å se en større versjon av denne figuren.
Protokollen beskrevet her bevarer myofiber- og adipocyttmorfologi og tillater visualisering og analyse av flere celletyper. Denne tilnærmingen er basert på immunfluorescensfarging av adipocytter i paraformaldehyd (PFA) -fast muskelvev, noe som muliggjør samfarging med flere antistoffer. Det kan også enkelt tilpasses for å romlig vise intramuskulært fett i intakt vev ved hjelp av helmontert avbildning, og dermed gi informasjon om det cellulære mikromiljøet av fett i muskelen. I tillegg kan denne protokollen kombineres med vår nylig publiserte tilnærming for å bestemme tverrsnittsarealet av myofibre i fast muskelvev31, en viktig måling for å vurdere muskelhelsen. Kombinere denne tilnærmingen med genetisk avstamningssporing for å skjebnekartlegge differensieringen av FAPs i adipocytter er også skissert her. Dermed muliggjør den allsidige protokollen beskrevet her streng og reproduserbar vurdering av FAPs og deres differensiering i intramuskulært fett i vevsseksjoner og intakt vev.
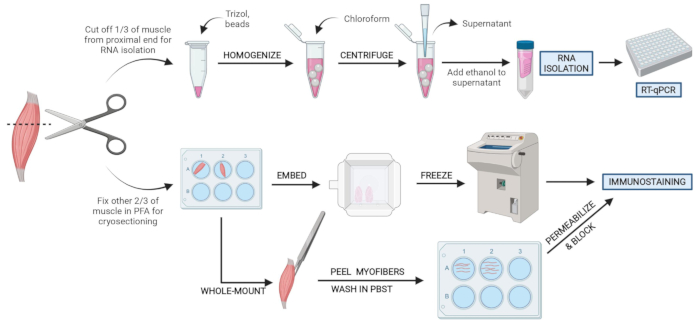
Figur 2: Skjematisk protokolloversikt. Skjematisk oversikt over vevsbehandling der en tredjedel av TA fjernes, snapfrosses og homogeniseres for påfølgende RNA-isolasjon og transkripsjonsanalyse via RT-qPCR. De andre to tredjedelene av TA er PFA-fast og behandlet for immunostaining på frosne seksjoner eller helmonterte fibre. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Denne protokollen skisserer en omfattende og detaljert protokoll som muliggjør effektiv visualisering og streng kvantifisering av intramuskulært fett. Ved å dele den samme muskelen i to deler, en som brukes til immunfluorescens og den andre for RT-qPCR-analyse, er denne protokollen også svært allsidig. Det kan også kombineres med genetisk avstamningssporing av FAPs for å studere deres konvertering til adipocytter under visse forhold, og er svært tilpasningsdyktig til å merke og avbilde flere ekstra celletyper.
De mest brukte måtene å visualisere intramuskulært fett er parafinseksjoner etterfulgt av hematoksylin- og eosinfarging eller frosne seksjoner farget for lipofile fargestoffer som Oil Red O (ORO). Men mens paraffinbehandlet vev opprettholder den beste histologien, trekker den samme prosessen også ut alle lipider som forhindrer bruk av lipofile fargestoffer. Selv om lipofile fargemetoder vil fungere på både PFA-faste og ufikserte vevsseksjoner, blir lipiddråper lett forskjøvet ved å påføre trykk på dekslippen, og derved forvrenge den romlige fordelingen av intramuskulært fett. For å omgå dette etablerte en nylig studie en streng protokoll for å visualisere ORO + adipocytter ved hjelp av en helmontert tilnærming. For dette decellulariserte forfatterne TA for å visualisere den romlige fordelingen av intramuskulært fett gjennom hele TA41. Så kraftig som denne teknikken er, forhindrer den også bruk av andre co-flekker for å markere flere cellulære strukturer. Hele mount immunfluorescensmetoden som presenteres her, kan brukes til å co-farge adipocytter med en rekke markører som muliggjør fin kartlegging av det cellulære miljøet. En stor utfordring er imidlertid vevspenetrasjon av antistoffene. Jo flere fibre som holdes sammen, desto vanskeligere vil det være for antistoffene å trenge inn og binde alle tilgjengelige antigener likt. Dermed er denne metoden mest effektiv når man ser på små grupper av fibre. Samtidig er dette også en begrensning ettersom den generelle anatomiske plasseringen av intramuskulært fett går tapt når man fokuserer på bare små, avskallede fiberbunter. Men med den nåværende utviklingen av nye vevsryddingsmetoder pluss ny bildebehandlingsteknologi, vil større vevspenetrasjon og visualisering være mulig i fremtiden 42,43,44.
Mens tidligere fiksering av muskelvev bevarer adipocyttmorfologi, skaper det også en utfordring å vurdere størrelsen på myofibre, en viktig måling av muskelhelse. Myofiberstørrelse bestemmes ved å måle tverrsnittsarealet av myofibre. Vi har tidligere rapportert at tidligere fiksering av muskelvev vil føre til at de fleste markører som er tilgjengelige for å skissere myofibre, mislykkes31. For å overvinne denne hindringen har vi utviklet en ny bildesegmenteringsrørledning, som gjør det mulig å måle myofiberstørrelse selv i faste muskelseksjoner31. Dermed har vi etablert en robust og effektiv vevsbehandlingsrørledning som, kombinert med denne protokollen, overvinner de fleste ulemper forårsaket av tidligere fiksering av muskelvev.
En annen stor fordel med denne tilnærmingen er allsidighet. Ved å dele TA i to deler maksimeres mengden informasjon som kan oppnås fra en muskel. Dette reduserer ikke bare antall dyr, men legger også til et ekstra lag med kontroll ved å bekrefte histologi gjennom genuttrykk og omvendt. I tillegg kan mange forskjellige gener undersøkes utover adipogene gener. Det isolerte RNA kan også brukes til et helt muskel RNAseq-eksperiment. Til slutt kan det snapfrosne muskelstykket også brukes til proteinarbeid. En begrensning ved denne protokollen er muligheten for at skaden ikke er konsistent over hele TA-lengden. Dette kan føre til et scenario der de to muskeldelene avviker i mengden intramuskulært fett de inneholder, og kan rettferdiggjøre utelukkelse av en slik prøve fra enhver nedstrømsanalyse. Det anbefales derfor ikke bare å stole på RT-qPCR for å trekke store konklusjoner om mengden intramuskulært fett, men heller som støttende data til de histologiske kvantifiseringene.
Sammen skisserer denne protokollen en robust, effektiv og streng vevsbehandlingsrørledning som vil tillate visualisering og kvantifisering av intramuskulært fett, det første trinnet i å utvikle nye behandlingsalternativer for å bekjempe fettfibrose. Samtidig er den allsidig og kan tilpasses mange forskjellige celletyper i muskelen, så vel som adipocytter i andre vev.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi takker medlemmene i Kopinke-laboratoriet for hjelp med datainnsamling og kritisk lesing av manuskriptet. Vi takker også medlemmene av Myology Institute ved University of Florida for verdifulle innspill til manuskriptet. Arbeidet ble støttet av NIH-tilskuddet 1R01AR079449. Figur 2 ble opprettet med Biorender.
Materials
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides – Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
References
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Biologie du développement. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).

