نمذجة ورم خبيث في الدماغ عن طريق حقن الشريان السباتي الداخلي للخلايا السرطانية
Summary
ورم خبيث في الدماغ هو سبب المراضة الشديدة والوفيات في مرضى السرطان. معظم نماذج الفئران ورم خبيث في الدماغ معقدة بسبب النقائل الجهازية التي تربك تحليل الوفيات ونتائج التدخل العلاجي. يظهر هنا بروتوكول للحقن السباتي الداخلي للخلايا السرطانية التي تنتج أوراما متسقة داخل الجمجمة مع الحد الأدنى من الأورام الجهازية.
Abstract
ورم خبيث في الدماغ هو سبب المراضة الشديدة والوفيات في مرضى السرطان. لا يمكن تكرار الجوانب الحرجة للأمراض النقيلية ، مثل البيئة الدقيقة العصبية المعقدة وتفاعل الخلايا اللحمية ، بالكامل باستخدام المقايسات في المختبر . وبالتالي ، فإن النماذج الحيوانية ضرورية للتحقيق في آثار التدخل العلاجي وفهمها. ومع ذلك ، فإن معظم طرق التطعيم الأجنبي لأورام الدماغ لا تنتج نقائل دماغية باستمرار من حيث الإطار الزمني وعبء الورم. يمكن أن تؤدي نماذج ورم خبيث في الدماغ الناتجة عن حقن الخلايا السرطانية داخل القلب إلى عبء ورم خارج الجمجمة غير مقصود وتؤدي إلى مراضة ووفيات غير منتشرة في الدماغ. على الرغم من أن الحقن داخل الجمجمة للخلايا السرطانية يمكن أن يحد من تكوين الورم خارج الجمجمة ، إلا أنه يحتوي على العديد من المحاذير ، مثل الخلايا المحقونة التي تشكل في كثير من الأحيان كتلة ورم مفردة في موقع الحقن ، وتورط leptomeningeal عالية ، وتلف الأوعية الدموية في الدماغ أثناء اختراق الإبرة. يصف هذا البروتوكول نموذج فأر لورم خبيث في الدماغ ناتج عن حقن الشريان السباتي الداخلي. تنتج هذه الطريقة أوراما داخل الجمجمة باستمرار دون إشراك أعضاء أخرى ، مما يتيح تقييم العوامل العلاجية لورم خبيث في الدماغ.
Introduction
ورم خبيث في الدماغ هو ورم خبيث سائد مرتبط بتشخيص سيء للغاية 1,2. معيار الرعاية لمرضى ورم خبيث في الدماغ متعدد الوسائط ، ويتكون من جراحة الأعصاب والعلاج الإشعاعي للدماغ بالكامل و / أو الجراحة الإشعاعية التجسيمية اعتمادا على الحالة الصحية العامة للمرضى ، وعبء المرض خارج الجمجمة ، وعدد وموقع الأورام في الدماغ 3,4. المرضى الذين يعانون من ما يصل إلى ثلاث آفات داخل الجمجمة مؤهلون للاستئصال الجراحي أو الجراحة الإشعاعية التجسيمية ، بينما يوصى بالعلاج الإشعاعي للدماغ بالكامل للمرضى الذين يعانون من آفات متعددة لتجنب خطر العدوى المرتبطة بالجراحة والوذمة5. ومع ذلك ، يمكن أن يتسبب العلاج الإشعاعي للدماغ بالكامل في إلحاق الضرر بهياكل الدماغ الحساسة للإشعاع ، مما يساهم في سوء نوعية الحياة6.
العلاج الجهازي هو بديل غير جراحي ونهج منطقي لعلاج المرضى الذين يعانون من آفات متعددة7. ومع ذلك ، فإنه أقل اعتبارا بسبب الفكرة القديمة بأن العلاجات الجهازية لها فعالية ضعيفة لأن التوصيل السلبي للأدوية السامة للخلايا عبر مجرى الدم لا يمكن أن يحقق مستويات علاجية في الدماغ دون التعرض لخطر السمية غير الآمنة8. بدأ هذا النموذج يتغير مع العلاج الجهازي المعتمد مؤخرا من إدارة الغذاء والدواء الأمريكية (FDA) (توكاتينيب مع تراستوزوماب وكابيسيتابين المشار إليهما لورم خبيث في الدماغ لسرطان الثدي HER2 + النقيلي)9،10،11،12 والتحديث في إرشادات العلاج لتشمل النظر في خيارات العلاج الجهازية لمرضى ورم خبيث في الدماغ13،14.
في هذا السياق ، يمكن للتطورات في مجال العلاج الجزيئي الموجه ، والعلاج المناعي ، وأنظمة توصيل الأدوية البديلة ، مثل ناقل الأدوية النانوية المستهدف ، التغلب على تحديات علاج ورم خبيث في الدماغ15،16،17،18. بالإضافة إلى ذلك ، يتم أيضا التحقيق في الأساليب الكيميائية والميكانيكية لتحسين توصيل الدواء عن طريق اختراق حاجز ورم الدماغ19,20. لدراسة وتحسين هذه الأساليب لتكون مناسبة للغرض ، من الأهمية بمكان استخدام النماذج قبل السريرية التي لا تعكس فقط الفسيولوجيا المعقدة لورم خبيث في الدماغ ولكن أيضا تسمح بالتحليل الموضوعي للاستجابة الدوائية داخل الجمجمة.
على نطاق واسع ، تتضمن الأساليب الحالية لنموذج ورم خبيث في الدماغ في الجسم الحي حقن الخلايا السرطانية داخل القلب (البطين الأيسر) أو الوريد (عادة الوريد الذيل) أو داخل الجمجمة أو داخل الشريان السباتي (الشريان السباتي المشترك) في الفئران21،22،23،24،25،26،27 . بصرف النظر عن استراتيجيات engraftment الورم ، فإن نماذج الفئران المعدلة وراثيا حيث يتم تشغيل تكوين الورم عن طريق إزالة الجينات المثبطة للورم أو تنشيط الجينات المسرطنة مفيدة لنمذجة الورم. ومع ذلك ، تم الإبلاغ عن عدد قليل فقط من نماذج الفئران المعدلة وراثيا لإنتاج أورام ثانوية وحتى أقل من ذلك تنتج بشكل موثوق النقائل الدماغية28،29،30.
تحاكي طرق Engraftment مثل الحقن داخل القلب (البطين الأيسر) والحقن في الوريد (عادة الوريد الذيل) الانتشار الجهازي للسرطان. تنتج هذه النماذج عادة آفات في أعضاء متعددة (مثل الدماغ والرئتين والكبد والكلى والطحال) اعتمادا على السرير الشعري الذي يحبس معظم الخلايا السرطانية أثناء “المرور الأول” في الدورة الدموية31. ومع ذلك ، فإن المعدلات غير المتسقة لنقش الدماغ ستتطلب المزيد من الحيوانات لتحقيق حجم العينة للقوة الإحصائية المطلوبة. عدد الخلايا السرطانية التي تنشأ في نهاية المطاف في الدماغ عن طريق طرق الحقن داخل القلب والوريد متغير. ومن ثم ، يمكن أن يختلف عبء ورم ورم ورم خبيث في الدماغ بين الحيوانات ويمكن أن يؤدي الاختلاف في التقدم إلى توحيد الجدول الزمني التجريبي وتفسير النتائج تحديا. يمكن أن يؤدي عبء الورم خارج الجمجمة إلى وفيات ورم خبيث غير دماغي ، مما يجعل هذه النماذج غير مناسبة لتقييم الفعالية داخل الجمجمة. تم إنشاء خطوط الخلايا المدارية للدماغ باستخدام عمليات الانتقاء النسيلي الاصطناعي لتقليل الإنشاء خارج الجمجمة ، لكن معدلات الاستيعاب كانت غير متسقة ، ويمكن لعملية الانتقاء النسيلي أن تقلل من عدم التجانس الموجود عادة في الأورام البشرية32.
تسمح طرق النقش الخاصة بالدماغ مثل الحقن داخل الجمجمة وداخل الشريان السباتي بنمذجة ورم خبيث في الدماغ أكثر اتساقا وكفاءة. في الطريقة داخل الجمجمة33 ، يتم حقن الخلايا السرطانية عادة في القشرة الدماغية الأمامية ، والتي تولد نموا سريعا وقابلا للتكاثر مع مشاركة جهازية منخفضة. في حين أن الإجراء جيد التحمل مع انخفاض معدل الوفيات33 ، فإن المحاذير هي أنه نهج بدائي نسبيا يقدم بسرعة بلعة (موضعية) للخلايا في الدماغ ولا يمثل التسبب المبكر في ورم خبيث في الدماغ. تدمر الإبرة الأوعية الدموية لأنسجة المخ ، مما يؤدي بعد ذلك إلى التهاب موضعي 5,34. من التجربة ، هناك ميل لحقن الخلايا السرطانية إلى الارتجاع أثناء إزالة الإبرة ، مما يؤدي إلى تورط leptomeningeal. بدلا من ذلك ، تقوم الطريقة داخل الشريان السباتي بتوصيل الخلايا إلى الشريان السباتي المشترك مع الأوعية الدموية الدقيقة في الدماغ كأول سرير شعري يتم مواجهته ، ونمذجة البقاء على قيد الحياة في الدورة الدموية ، والتسرب ، والاستعمار24. بالاتفاق مع الآخرين25 ، وجدت تجربتنا مع هذه الطريقة أنه يمكن أن يؤدي إلى أورام الوجه بسبب التسليم غير المقصود للخلايا السرطانية عبر الشريان السباتي الخارجي إلى أسرة الشعيرات الدموية في هذه الأنسجة (بيانات غير منشورة). من الممكن منع أورام الوجه عن طريق ربط الشريان السباتي الخارجي أولا قبل حقن الشريان السباتي الشائع (الشكل 1). في بقية المقالة ، يشار إلى هذه الطريقة باسم “حقن الشريان السباتي الداخلي”. من التجربة ، تولد طريقة حقن الشريان السباتي الداخلي باستمرار ورم خبيث في الدماغ مع عدد قليل جدا من الأحداث الجهازية وقد نجحت في توليد نماذج ورم خبيث في الدماغ لسرطانات أولية مختلفة (مثل سرطان الجلد وسرطان الثدي والرئة) (الشكل 1). العيوب هي أنها صعبة تقنيا ، وتستغرق وقتا طويلا ، وغازية ، وتتطلب تحسينا دقيقا لأرقام الخلايا وجدولا زمنيا للمراقبة. باختصار ، تنتج كل من طرق حقن الشريان السباتي داخل الجمجمة والداخلية نماذج فأر مناسبة لتقييم التأثير العلاجي على فائدة البقاء على قيد الحياة المرتبطة بورم الدماغ.
يصف هذا البروتوكول طريقة حقن الشريان السباتي الداخلي لإنتاج نموذج فأر من ورم خبيث في الدماغ دون أي مشاركة نظامية تقريبا ، وبالتالي فهو مناسب للتقييم قبل السريري لتوزيع الأدوية وفعالية العلاجات التجريبية.
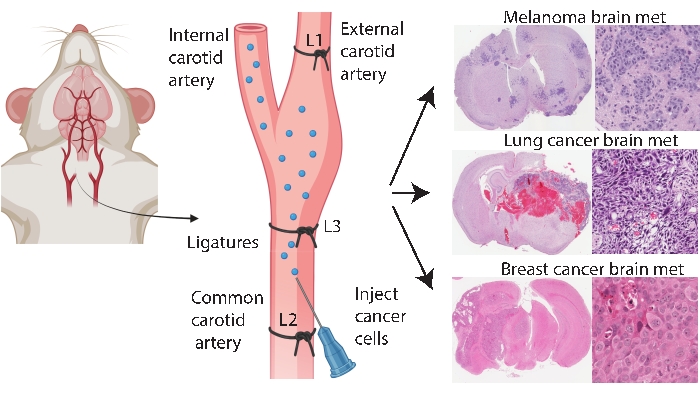
الشكل 1: تمثيل تخطيطي لبروتوكول حقن الشريان السباتي الداخلي لورم خبيث في الدماغ. يمكن أن ينتج حقن الشريان السباتي الداخلي مع ربط الشريان السباتي الخارجي بشكل موثوق نموذج ورم خبيث في الدماغ من مختلف أنواع السرطان الأولية. في هذا البروتوكول ، يتم وضع ثلاثة أحرف مركبة على الشريان السباتي (مشروح ك L1-L3 في الشكل). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
Representative Results
Discussion
ورم خبيث في الدماغ هو عملية معقدة تنتشر فيها الخلايا السرطانية من موقعها الأساسي إلى الدماغ. تتوفر نماذج حيوانية مختلفة تعكس مراحل معينة من هذه العملية متعددة الخطوات وهناك اعتبارات فسيولوجية وعملية لتصميم دراسات ورم خبيث قبل السريرية41،42. استخدمت معظم ال?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
تم تمويل هذا البحث من قبل المجلس الوطني الأسترالي للصحة والبحوث الطبية (NHMRC) ، رقم المنحة APP1162560. تم تمويل ML من خلال منحة أبحاث الدراسات العليا بجامعة كوينزلاند. نود أن نشكر كل من ساعد في تربية الحيوانات والتصوير الحي للحيوانات. نشكر مستشفى بريسبان الملكي والنساء على التبرع بحصص الزركونيوم لهذه الدراسة.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Recherche en cancérologie. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Recherche en cancérologie. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Recherche en cancérologie. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

