Modellering af hjernemetastase ved intern halspulsåreinjektion af kræftceller
Summary
Hjernemetastase er en årsag til alvorlig sygelighed og dødelighed hos kræftpatienter. De fleste hjernemetastase musemodeller kompliceres af systemiske metastaser, der forvirrer analyse af dødelighed og terapeutiske interventionsresultater. Præsenteret her er en protokol for intern carotisinjektion af kræftceller, der producerer konsistente intrakranielle tumorer med minimale systemiske tumorer.
Abstract
Hjernemetastase er en årsag til alvorlig sygelighed og dødelighed hos kræftpatienter. Kritiske aspekter af metastatiske sygdomme, såsom det komplekse neurale mikromiljø og stromal celleinteraktion, kan ikke helt replikeres med in vitro-assays ; Dyremodeller er således afgørende for at undersøge og forstå virkningerne af terapeutisk intervention. Imidlertid producerer de fleste hjernetumor xenograferingsmetoder ikke hjernemetastaser konsekvent med hensyn til tidsrammen og tumorbyrden. Hjernemetastasemodeller genereret ved intrakardial injektion af kræftceller kan resultere i utilsigtet ekstrakraniel tumorbyrde og føre til ikke-hjernemetastatisk sygelighed og dødelighed. Selvom intrakraniel injektion af kræftceller kan begrænse ekstrakraniel tumordannelse, har den flere forbehold, såsom at de injicerede celler ofte danner en enestående tumormasse på injektionsstedet, høj leptomeningeal involvering og skade på hjernens vaskulatur under nåleindtrængning. Denne protokol beskriver en musemodel af hjernemetastase genereret ved intern carotisarterieinjektion. Denne metode producerer intrakranielle tumorer konsekvent uden involvering af andre organer, hvilket muliggør evaluering af terapeutiske midler til hjernemetastase.
Introduction
Hjernemetastase er en udbredt malignitet forbundet med en meget dårlig prognose 1,2. Standarden for pleje af hjernemetastasepatienter er multimodal, bestående af neurokirurgi, helhjernestrålebehandling og / eller stereotaktisk radiokirurgi afhængigt af patienternes generelle sundhedsstatus, ekstrakraniel sygdomsbyrde og antallet og placeringen af tumorer i hjernen 3,4. Patienter med op til tre intrakranielle læsioner er berettiget til kirurgisk resektion eller stereotaktisk radiokirurgi, mens helhjernestrålebehandling anbefales til patienter med flere læsioner for at undgå risikoen for kirurgisk relateret infektion og ødem5. Imidlertid kan hele hjernens strålebehandling forårsage skade på radiofølsomme hjernestrukturer, hvilket bidrager til dårlig livskvalitet6.
Systemisk terapi er en ikke-invasiv alternativ og logisk tilgang til behandling af patienter med flere læsioner7. Det overvejes dog mindre på grund af den mangeårige forestilling om, at systemiske terapier har dårlig effekt, fordi passiv levering af cytotoksiske lægemidler via blodbanen ikke kan opnå terapeutiske niveauer i hjernen uden risiko for usikker toksicitet8. Dette paradigme begynder at ændre sig med den nyligt godkendte systemiske behandling (tucatinib med trastuzumab og capecitabin indiceret til metastatisk HER2+ brystkræfthjernemetastase)9,10,11,12 og opdateringen i behandlingsretningslinjer til at omfatte overvejelse af systemiske behandlingsmuligheder for hjernemetastasepatienter13,14.
I denne sammenhæng kan udviklingen inden for molekylær målrettet terapi, immunterapi og alternative lægemiddelleveringssystemer, såsom en målrettet nano-lægemiddelbærer, potentielt overvinde udfordringerne ved hjernemetastasebehandling15,16,17,18. Derudover undersøges også kemiske og mekaniske tilgange til forbedring af lægemiddelafgivelse via permeabilisering af hjernetumorbarrieren19,20. For at studere og optimere sådanne tilgange til at være egnede til formålet er det afgørende at anvende prækliniske modeller, der ikke kun afspejler den komplekse fysiologi af hjernemetastase, men også giver mulighed for objektiv analyse af intrakranielt lægemiddelrespons.
Generelt involverer de nuværende tilgange til modelhjernemetastase in vivo intracardiac (venstre ventrikel), intravenøs (normalt halevene), intrakraniel eller intracarotis (almindelig halspulsåre) injektion af kræftceller hos mus 21,22,23,24,25,26,27 . Bortset fra tumor engraftment strategier, genetisk manipulerede musemodeller, hvor tumordannelse udløses ved fjernelse af tumor suppressor gener eller aktivering af onkogener er nyttige til tumor modellering. Imidlertid rapporteres kun få genetisk manipulerede musemodeller at producere sekundære tumorer og endnu færre, der pålideligt producerer hjernemetastaser28,29,30.
Engraftment metoder såsom intracardiac (venstre ventrikel) og intravenøs (normalt hale vene) injektion efterligne den systemiske spredning af kræft. Disse modeller producerer typisk læsioner i flere organer (f.eks. hjerne, lunger, lever, nyrer, milt) afhængigt af kapillærsengen, der fanger de fleste tumorceller under deres kredsløb ‘første pas’31. Imidlertid vil inkonsekvente hjernetransplantationshastigheder kræve flere dyr for at opnå stikprøvestørrelsen for den ønskede statistiske effekt. Antallet af tumorceller, der til sidst bliver etableret i hjernen via disse intrakardiale og intravenøse injektionsmetoder, er variabelt. Derfor kan hjernemetastase tumorbyrde variere mellem dyr, og forskellen i progression kan gøre standardisering af den eksperimentelle tidslinje og fortolkning af resultater til en udfordring. Den ekstrakranielle tumorbyrde kan føre til ikke-hjernemetastasedødelighed, hvilket gør disse modeller uegnede til evaluering af intrakraniel effekt. Hjerne-tropiske cellelinjer er blevet etableret ved hjælp af kunstige klonale selektionsprocesser for at reducere ekstrakraniel etablering, men optagelseshastigheder har været inkonsekvente, og den klonale udvælgelsesproces kan reducere heterogeniteten, der normalt findes i humane tumorer32.
Hjernespecifikke engraftmentmetoder såsom intrakraniel og intracarotisinjektion giver mulighed for mere konsekvent og effektiv hjernemetastasemodellering. I den intrakranielle metode33 injiceres kræftceller typisk i den frontale hjernebark, som genererer hurtig og reproducerbar tumorudvækst med lav systemisk involvering. Mens proceduren tolereres godt med lav dødelighed33, er advarslerne, at det er en relativt rå tilgang, der hurtigt introducerer en (lokaliseret) bolus af celler i hjernen og ikke modellerer tidlig hjernemetastasepatogenese. Nålen beskadiger hjernevævsvaskulaturen, som derefter forårsager lokaliseret betændelse 5,34. Fra erfaring er der en tendens til, at tumorcelleinjektion til tilbagesvaling under fjernelse af nålen, hvilket fører til leptomeningeal involvering. Alternativt leverer intracarotismetoden celler ind i den fælles halspulsåre med hjernemikrovaskulatur som den første kapillærseng, der opstår, modellering af overlevelse i omløb, ekstravasation og kolonisering24. I overensstemmelse med andre25 fandt vores erfaring med denne metode, at den kan resultere i ansigtstumorer på grund af utilsigtet levering af kræftceller via den eksterne halspulsåre til kapillærsenge i disse væv (upublicerede data). Det er muligt at forhindre ansigtstumorer ved først at ligere den ydre halspulsåre før injektion af almindelig halspulsåre (figur 1). I resten af artiklen omtales denne metode som ‘indre halspulsåreinjektion’. Fra erfaring genererer den interne halspulsåreinjektionsmetode konsekvent hjernemetastase med meget få systemiske hændelser og har haft succes med at generere hjernemetastasemodeller af forskellige primære kræftformer (fx melanom, bryst- og lungekræft) (figur 1). Ulemperne er, at det er teknisk udfordrende, tidskrævende, invasivt og kræver omhyggelig optimering af cellenumre og en overvågningstidslinje. Sammenfattende producerer både de intrakranielle og interne carotisarterieinjektionsmetoder musemodeller, der er egnede til evaluering af terapeutisk indvirkning på hjernetumorrelateret overlevelsesfordel.
Denne protokol beskriver den interne carotisarterieinjektionsmetode til fremstilling af en musemodel af hjernemetastase med næsten ingen systemisk involvering og derfor egnet til præklinisk evaluering af lægemiddelfordeling og effektivitet af eksperimentel terapi.
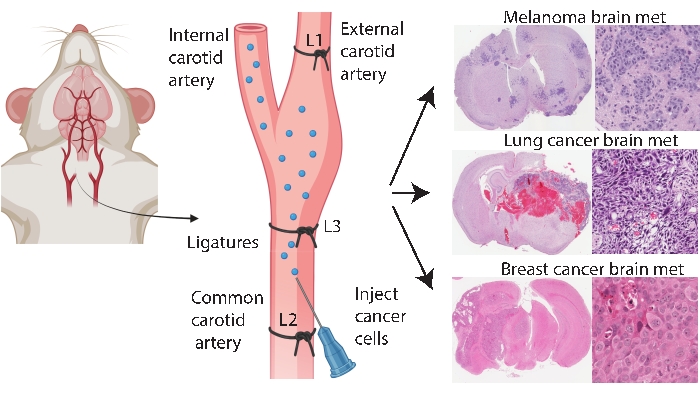
Figur 1: Skematisk repræsentation af intern carotisarterieinjektionsprotokol for hjernemetastase. Intern halspulsåreinjektion med ekstern halspulsåreligation kan pålideligt producere en hjernemetastasemodel fra forskellige primære kræftformer. I denne protokol placeres tre ligaturer på halspulsåren (kommenteret som L1-L3 i figuren). Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Hjernemetastase er en kompleks proces af kræftceller, der spredes fra deres primære sted til hjernen. Der findes forskellige dyremodeller, der afspejler visse stadier af denne flertrinsproces, og der er fysiologiske og praktiske overvejelser ved at designe prækliniske metastasestudier41,42. De fleste offentliggjorte undersøgelser, der undersøger brugen af nanomedicin til hjernemetastasebehandling, har brugt intrakardiale43,44 og intra…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev finansieret af The Australian National Health and Medical Research Council (NHMRC), tilskudsnummer APP1162560. ML blev finansieret af et UQ postgraduate forskningsstipendium. Vi vil gerne takke alle, der hjalp med dyrehold og in vivo-billeddannelse af dyrene. Vi takker Royal Brisbane and Women’s Hospital for at donere aliquots af zirconium til denne undersøgelse.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Recherche en cancérologie. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Recherche en cancérologie. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Recherche en cancérologie. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

