암세포의 내경동맥 주입에 의한 뇌전이 모델링
Summary
뇌 전이는 암 환자의 심각한 이환율과 사망률의 원인입니다. 대부분의 뇌 전이 마우스 모델은 사망률 및 치료 개입 결과의 혼란 분석을 혼란시키는 전신 전이에 의해 복잡합니다. 여기에 제시된 것은 최소한의 전신 종양으로 일관된 두개 내 종양을 생성하는 암세포의 내 경동맥 주사를위한 프로토콜입니다.
Abstract
뇌 전이는 암 환자의 심각한 이환율과 사망률의 원인입니다. 복잡한 신경 미세 환경 및 기질 세포 상호 작용과 같은 전이성 질환의 중요한 측면은 시험관 내 분석으로 완전히 복제 할 수 없습니다. 따라서 동물 모델은 치료 적 개입의 효과를 조사하고 이해하는 데 중요합니다. 그러나 대부분의 뇌종양 이종 이식 방법은 시간 프레임과 종양 부담 측면에서 지속적으로 뇌 전이를 일으키지 않습니다. 암세포의 심장 내 주사에 의해 생성 된 뇌 전이 모델은 의도하지 않은 두개 외 종양 부담을 초래할 수 있으며 비 뇌 전이성 이환율 및 사망률을 초래할 수 있습니다. 암세포의 두개내 주사는 두개외 종양 형성을 제한할 수 있지만, 주사된 세포가 주사 부위에서 종종 단일 종양 덩어리를 형성하고, 높은 렙토메닌질 침범, 바늘 침투 중 뇌 혈관 구조 손상과 같은 몇 가지 주의 사항이 있습니다. 이 프로토콜은 내 경동맥 주사에 의해 생성 된 뇌 전이의 마우스 모델을 설명합니다. 이 방법은 다른 장기의 침범없이 일관되게 두개 내 종양을 생성하여 뇌 전이 치료제를 평가할 수 있습니다.
Introduction
뇌 전이는 매우 나쁜 예후와 관련된 널리 퍼진 악성 종양입니다 1,2. 뇌 전이 환자의 표준 치료는 환자의 일반적인 건강 상태, 두개외 질환 부담, 뇌 종양의 수와 위치에 따라 신경외과,전뇌 방사선 요법 및/또는 정위 방사선 수술로 구성된 다중 모드입니다3,4. 최대 3개의 두개내 병변이 있는 환자는 외과적 절제 또는 정위 방사선 수술을 받을 수 있으며, 다발성 병변이 있는 환자는 수술 관련 감염 및 부종의 위험을 피하기 위해 전뇌 방사선 요법을권장합니다5. 그러나 전뇌 방사선 치료는 방사능에 민감한 뇌 구조에 손상을 주어 삶의 질을 저하시킬 수 있습니다6.
전신 요법은 다발성 병변 환자를 치료하기 위한 비침습적 대안적이고 논리적인 접근법이다7. 그러나 혈류를 통한 세포 독성 약물의 수동 전달은 안전하지 않은 독성의 위험 없이는 뇌에서 치료 수준을 달성 할 수 없기 때문에 전신 요법이 효능이 좋지 않다는 오랜 개념으로 인해 덜 고려됩니다8. 이 패러다임은 최근 미국 식품의약국(FDA)이 승인한 전신 요법(전이성 HER2+ 유방암 뇌 전이에 대해 트라스투주맙 및 카페시타빈을 사용한 투카티닙)9,10,11,12 및 뇌 전이 환자에 대한 전신 요법 옵션 고려를 포함하는 치료 지침의 업데이트로 변화하기 시작했습니다13,14.
이러한 맥락에서, 분자 표적 요법, 면역 요법 및 표적 나노-약물 운반체와 같은 대체 약물 전달 시스템 분야의 개발은 잠재적으로 뇌 전이 치료15,16,17,18의 도전을 극복할 수 있다. 또한 뇌종양 장벽의 투과화를 통해 약물 전달을 개선하기위한 화학적 및 기계적 접근법도 조사되고 있습니다19,20. 이러한 접근법을 목적에 맞게 연구하고 최적화하려면 뇌 전이의 복잡한 생리학을 반영할 뿐만 아니라 두개내 약물 반응의 객관적인 분석을 허용하는 전임상 모델을 사용하는 것이 중요합니다.
대체로, 생체 내에서 뇌 전이를 모델링하기 위한 현재의 접근법은 마우스에서 암세포의 심장내(좌심실), 정맥내(일반적으로 꼬리 정맥), 두개내 또는 경동맥내(총경동맥) 주사를 포함합니다 21,22,23,24,25,26,27 . 종양 생착 전략 외에도, 종양 억제 유전자의 제거 또는 종양 유전자의 활성화에 의해 종양 형성이 촉발되는 유전자 조작 마우스 모델은 종양 모델링에 유용하다. 그러나 유전자 조작 마우스 모델은 소수에 불과하여 이차 종양을 생성하는 것으로 보고되었으며 뇌 전이를 안정적으로 생성하는 모델은 훨씬 적습니다28,29,30.
심장 내 (좌심실) 및 정맥 주사 (보통 꼬리 정맥) 주사와 같은 생착 방법은 암의 전신 전파를 모방합니다. 이러한 모델은 일반적으로 순환기 ‘첫 번째 통과’31 동안 대부분의 종양 세포를 가두는 모세 혈관에 따라 여러 장기 (예 : 뇌, 폐, 간, 신장, 비장)에 병변을 생성합니다. 그러나 뇌 생착의 일관되지 않은 속도는 원하는 통계적 검정력에 대한 샘플 크기를 달성하기 위해 더 많은 동물을 필요로합니다. 이러한 심장 내 및 정맥 주사 방법을 통해 결국 뇌에 확립되는 종양 세포의 수는 다양합니다. 따라서 뇌 전이 종양 부담은 동물마다 다를 수 있으며 진행의 차이로 인해 실험 일정을 표준화하고 결과를 해석하는 것이 어려울 수 있습니다. 두개외 종양 부담은 비뇌 전이 사망률로 이어질 수 있으며, 이러한 모델은 두개내 효능을 평가하는 데 적합하지 않습니다. 뇌-트로픽 세포주는 두개외 확립을 감소시키기 위해 인공 클론 선택 과정을 사용하여 확립되었지만, 복용률은 일관되지 않았고, 클론 선택 과정은 인간 종양에서 정상적으로 발견되는 이질성을 감소시킬 수 있다(32).
두개내 및 경동맥 내 주사와 같은 뇌 특이적 생착 방법은 보다 일관되고 효율적인 뇌 전이 모델링을 가능하게 합니다. 두개내 방법(33)에서, 암세포는 전형적으로 전두대뇌 피질 내로 주입되며, 이는 낮은 전신 침범으로 빠르고 재현가능한 종양 성장을 생성한다. 이 절차는 낮은 사망률로 잘 견디지만33, 주의할 점은 뇌에 (국소화된) 세포 덩어리를 빠르게 도입하고 초기 뇌 전이 병인을 모델링하지 않는 비교적 조잡한 접근 방식이라는 것입니다. 바늘은 뇌 조직 혈관을 손상시켜 국소 염증 5,34를 유발합니다. 경험에 비추어 볼 때, 바늘을 제거하는 동안 종양 세포 주사가 역류하는 경향이 있으며, 이는 렙토메닌 침범으로 이어집니다. 대안적으로, 경동맥 내 방법은 뇌 미세 혈관계를 갖는 세포를 총 경동맥으로 전달하여 순환, 혈관 외 유출 및 식민지화24에서의 생존을 모델링한다. 다른사람들과 일치 25,이 방법에 대한 우리의 경험은 외부 경동맥을 통해 이러한 조직의 모세 혈관으로 암세포를 의도하지 않게 전달하여 안면 종양을 유발할 수 있음을 발견했습니다 (미공개 데이터). 일반적인 경동맥 주사 전에 먼저 외부 경동맥을 결찰함으로써 안면 종양을 예방할 수 있습니다 (그림 1). 기사의 나머지 부분에서는이 방법을 ‘내 경동맥 주사’라고합니다. 경험을 통해 내경동맥 주사 방법은 전신적 사건이 거의 없는 뇌 전이를 지속적으로 생성하며 다양한 원발성 암(예: 흑색종, 유방암 및 폐암)의 뇌 전이 모델을 생성하는 데 성공했습니다(그림 1). 단점은 기술적으로 까다롭고 시간이 많이 걸리고 침습적이며 세포 수와 모니터링 일정을 신중하게 최적화해야 한다는 것입니다. 요약하면, 두개내 및 내경동맥 주사 방법 모두는 뇌종양 관련 생존 이점에 대한 치료 효과를 평가하기에 적합한 마우스 모델을 생성한다.
이 프로토콜은 내 경동맥 주사 방법을 설명하여 전신 침범이 거의없는 뇌 전이의 마우스 모델을 생성하므로 약물 분포 및 실험 치료제의 효능에 대한 전임상 평가에 적합합니다.
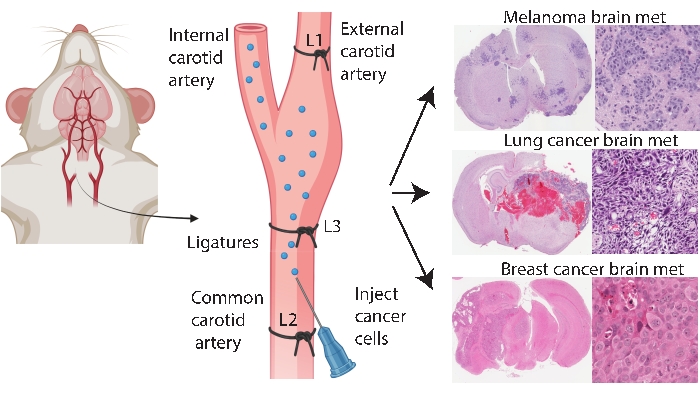
그림 1: 뇌 전이를 위한 내경동맥 주입 프로토콜의 개략적인 표현. 외부 경동맥 결찰을 통한 내 경동맥 주사는 다양한 원발성 암으로부터 뇌 전이 모델을 신뢰성있게 생성 할 수있다. 이 프로토콜에서는 3 개의 합자가 경동맥에 배치됩니다 (그림에서 L1-L3으로 주석이 달림). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
뇌 전이는 암세포가 원발성 부위에서 뇌로 퍼지는 복잡한 과정입니다. 이 다단계 과정의 특정 단계를 반영하는 다양한 동물 모델을 사용할 수 있으며 전임상 전이 연구41,42를 설계하는 데 생리적, 실제적 고려 사항이 있습니다. 뇌 전이 치료를위한 나노 의학의 사용을 조사하는 대부분의 발표 된 연구는 심장 내43,44 및 두개 내 45,46,47,48…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 연구는 호주 국립 보건 및 의학 연구위원회 (NHMRC), 보조금 번호 APP1162560의 자금 지원을 받았습니다. ML은 UQ 대학원 연구 장학금으로 자금을 지원받았습니다. 축산과 동물의 생체 내 이미징을 도와 주신 모든 분들께 감사드립니다. 이 연구를 위해 지르코늄 분취량을 기증해 주신 Royal Brisbane and Women’s Hospital에 감사드립니다.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Recherche en cancérologie. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Recherche en cancérologie. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Recherche en cancérologie. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

