Påvisning af unormalt prionprotein ved immunhistokemi
Summary
Immunmærkning af unormalt prionprotein ved hjælp af immunhistokemiske protokoller kræver specifikke prøve- og anti-PrP-antistofpræparationsmetoder. Denne protokol beskriver de vigtigste trin i epitopmaskering for at sikre korrekt PrP-immunmærkning og for at minimere ikke-specifik baggrundsfarvning. Denne tilgang overvejer også biosikkerhedsforanstaltninger ved udførelse af immunhistokemiske undersøgelser med de prioninficerede væv.
Abstract
Unormale prionproteiner (PrPSc) er den sygdomsassocierede isoform af cellulært prionprotein og diagnostiske markører for transmissible spongiforme encephalopatier (TSE’er). Disse neurodegenerative sygdomme påvirker mennesker og flere dyrearter og omfatter scrapie, zoonotisk bovin spongiform encephalopati (BSE), chronic wasting disease hos hjortedyr (CWD) og den nyligt identificerede kamelprionsygdom (CPD). Diagnosticering af TSE er afhængig af immunpåvisning af PrPSc ved anvendelse af både immunhistokemi (IHC) og vestlige immunoblotmetoder (WB) på encefalonvæv, nemlig hjernestammen (obex-niveau). IHC er en meget anvendt metode, der bruger primære antistoffer (monoklonale eller polyklonale) mod antigener af interesse i celler i en vævssektion. Antistof-antigenbindingen kan visualiseres ved en farvereaktion, der forbliver lokaliseret i det område af vævet eller cellen, hvor antistoffet var målrettet. Som sådan anvendes immunhistokemiske teknikker i prionsygdomme som inden for andre forskningsområder ikke kun til diagnostiske formål, men også i patogeneseundersøgelser. Sådanne undersøgelser involverer påvisning af PrPSc-mønstre og -typer fra dem, der tidligere er beskrevet, for at identificere de nye prionstammer. Da BSE kan inficere mennesker, anbefales det, at faciliteter og/eller praksis på biosikkerhedslaboratorieniveau 3 (BSL-3) anvendes til håndtering af kvæg, små drøvtyggere og hjortedyrprøver, der indgår i TSE-overvågningen. Derudover anbefales indeslutnings- og priondedikeret udstyr, når det er muligt, for at begrænse kontaminering. PrPSc IHC-proceduren består af et myresyreepitop-demmaskeringstrin, der også fungerer som en prioninaktiveringsforanstaltning, da formalinfikseret og paraffinindlejret væv, der anvendes i denne teknik, forbliver smitsomt. Ved fortolkning af resultaterne skal man sørge for at skelne ikke-specifik immunmærkning fra målmærkning. Til dette formål er det vigtigt at genkende artefakter af immunmærkning opnået i kendte TSE-negative kontroldyr for at skelne dem fra specifikke PrP Sc-immunmærkningstyper, som kan variere mellem TSE-stammer, værtsarter og prnp-genotype, yderligere beskrevet heri.
Introduction
Ifølge prionhypotesen er den abnorme isoform (PrPSc) den primære eller eneste komponent i det infektiøse agens i transmissible spongiforme encephalopatier (TSE’er). Bekræftelse til diagnosticering af TSE afhænger af immunpåvisning af PrPSc ved anvendelse af immunhistokemiske (IHC) protokoller og/eller vestlige immunblotmetoder (WB) af encefalonvæv1.
IHC er en metode, der anvender monoklonale eller i nogle tilfælde polyklonale antistoffer (som primære antistoffer) som et første trin i immunfarvning af specifikt målrettede antigener af interesse placeret i celler i en vævssektion. Enhver effektiv primær antistof-antigenbinding visualiseres derefter ved hjælp af sekundære antistoffer, der er specifikke for de primære antistoffer. Disse sekundære antistoffer konjugeres til enzymer, såsom peberrodsperoxidase (HRP) eller alkalisk fosfatase (AP). Visualisering opnås derefter ved at tilføje et substrat til disse enzymer, der producerer uopløselige farveprodukter lokaliseret i områder, hvor de primære antistoffer er bundet til de målrettede antigener. Forbedret visualisering kan opnås ved modfarvning, hvor et farvestof bruges til at skabe en kontrast mellem immunmærket og ikke-immunmærket væv2.
Ved IHC ved anvendelse af formalinfikseret paraffinindlejret væv (FFPE) kan formalinfiksering ophæve effektiviteten af primære antistoffer på grund af tværbinding med formaldehyd og opvarmning og dehydrering under paraffinindlejring. Disse ændrer konformationen af proteiner, ødelægger, denaturerer eller maskerer epitoperne og mindsker eller ophæver dermed deres påvisning3. Som sådan kræver dette antigenhentning (AR). AR-teknikkerne forstyrrer formaldehydrelateret kemisk gruppetværbinding i de antigene molekyler og genopretter eller afslører således den oprindelige antigen-proteinkonformation. Dette resulterer i at genvinde antistof-antigen (epitop) affinitet til immunmærkning. Den endelige effekt af AR afhænger af kvaliteten af det målrettede antigen og / eller det primære antistof2.
Varmeinduceret antigen (epitop) hentning (HIER) er en procedure i AR3 og anvendes rutinemæssigt til PrPSc IHC-detektion, som beskrevet heri. IHC er afgørende for diagnose og anvendes i forskningslaboratorier til at bestemme vævsfordelingen af et patologiassocieret antigen. Det bruges i vid udstrækning til diagnosticering og forskning i kræft, neurovidenskab og infektionssygdomme4, blandt andre. For TSE spiller IHC en vigtig rolle i diagnosticering og forskning til bekræftelse og undersøgelse af PrPSc-fordeling i naturlige værter og eksperimentelle modeller. IHC bidrager til prionpatogeneseundersøgelser og analyse af PrP Sc-aflejringstyper og -mønstre, nemlig i neurale væv5, for at påvise afvigelser fra rutinemæssigt beskrevne infektioner og identificere formodede nye prionstammer.
Da prioner af bovin spongiform encephalopati (BSE) kan inficere mennesker, kan visse laboratorieprotokoller, der er involveret i arbejdet med BSE, kræve anvendelse af BSL-3-faciliteter og -praksis6. Disse omfatter anvendelse af en forseglet sekundær beholder til transport af potentielle BSE-inficerede vævsprøver inden for instituttet og laboratoriet. Det omfatter også udpegelse af indeslutningsområder og prionsærligt udstyr til BSE-forskning og -analyse, når det er muligt. Dette gøres for at forhindre kontaminering uden for arbejdsområdet og give et begrænset rum, da dekontamineringsprocedurer bliver nødvendige.
I overensstemmelse hermed følger laboratoriet for patologi i INIAV anbefalede faciliteter og praksis for biosikkerhedsniveau-3 (BSL-3)6 for at håndtere potentielle prioninficerede prøver af væv fra kvæg, små drøvtyggere og hjortedyr, der er forbundet med TSE-overvågningen.
Formalinfikseret og paraffinindlejret væv, der indgår i TSE-diagnosticerings- eller forskningsprocedurer, især i centralnervesystemet, kan være potentielt smitsomt. Derfor skal disse faste væv behandles med myresyre for at reducere smitsomheden af prioner, hvis de er til stede, før vævsbehandling. Dette udføres ved at placere faste, trimmede væv (ca. 2-4 mm tykkelse) i en behandlingskassette. Kassetten nedsænkes derefter i 98% myresyre (i 1 time). Efter nedsænkning vaskes kassetterne med væv i rindende ledningsvand i 30 minutter og returneres til fikseringsmidlet inden videre behandling. Hvis vævssektioner ikke behandles før behandling, skal postmikrotomiske vævssektioner nedsænkes i ufortyndet myresyre i mindst 5 minutter før histologisk farvning7. IHC-protokollen for PrPSc inkluderer et rutinemæssigt myresyreepitop-demmaskeringstrin, der også tjener til at inaktivere prioner7. Efter disse prioninaktiveringstrin kan det resulterende faste væv derefter behandles ved BSL-2 ved hjælp af standard BSL-2-praksis.
Minimumskravet til vævsprøvetagning til TSE-diagnosticering hos alle dyr, der er omfattet af TSE-overvågningen, er indsamling af hjernestammen (på obex-niveau). For at påvise atypisk BSE og scrapie anbefales det desuden, at en del af lillehjernen også indsamles 1,8. Til CWD-diagnose bør både hjernestamme (obex) og retropharyngeale lymfeknuder testes, da PrP Sc kunne påvises i lymfoide væv uden påviselig PrPSc i obex9, gennemgået af Machado et al.10.
Den obex-del af hjernestammen omfatter diagnostiske TSE-målsteder, nemlig dorsal vagalkernen (DVN), ensomhedskanalkernen (STN) og rygmarvskernen i trigeminusnerven (V). Disse områder udviser konsekvent bilateral akkumulering af PrPSc , selv i de tidlige stadier af BSE og klassisk scrapie. I kliniske tilfælde af fremskreden TSE viser alle gråstofområder i hjernestammen udbredt PrPSc-fordeling 11.
Før sektionering og behandling evalueres hjerneprøverne (figur 1) for at fastslå autolyseniveauet og tilstedeværelsen af eventuelle vævsskader, der potentielt kan kompromittere prøvens egnethed til IHC-baseret bekræftende diagnose8. For at validere integriteten af de præparative protokoller og analyseresultaterne indgår TSE-positive og negative vævsprøver som kontroller i forbindelse med fremstilling af væv fra testtilfælde i hvert assay.
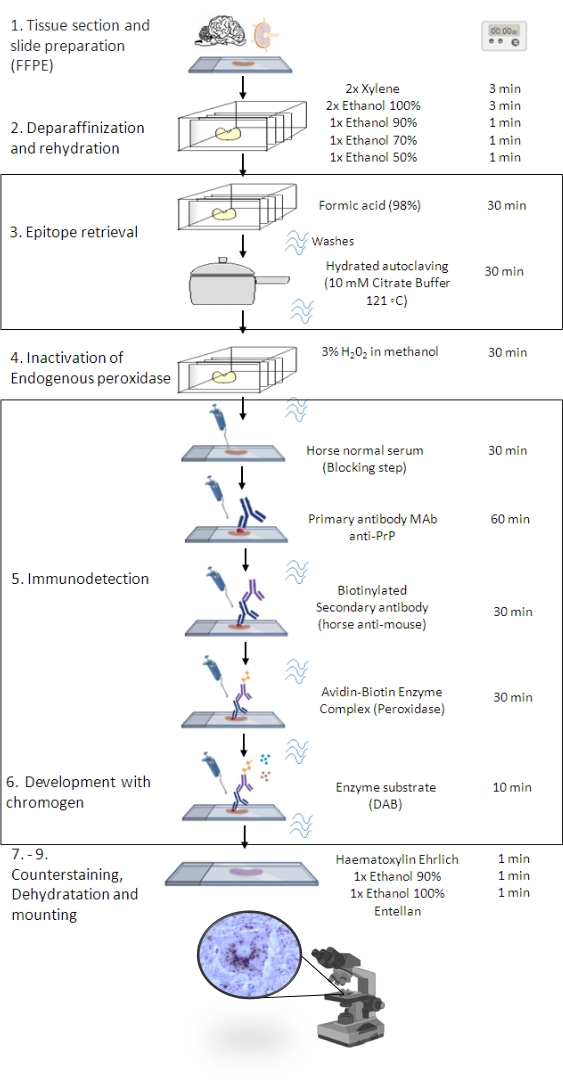
Figur 1: PrPSc IHC-proceduren. Repræsentation, der viser den trinvise sekvens af PrPSc IHC-proceduren fra deparaffinisering af vævssektioner til eventuel immunfarvning og detektion (FFPE – Formalin-fixed paraffin-embedded; Mab – monoklonalt antistof; DAB – 3,3′ diaminobenzidin). Denne figur blev oprettet i BioRender.com. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
TSE er potentielle zoonotiske sygdomme. Efter fremkomsten af BSE i 1986 i Det Forenede Kongerige blev Portugal en af de EU-medlemsstater, der havde en højere forekomst af denne sygdom14,15. For at bekæmpe denne sygdom er der udviklet andre TSE’er (klassisk og atypisk scrapie, BSE-varianter og i øjeblikket overvågning af chronic wasting disease hos hjortedyr), overvågningsmekanismer af Generaldirektoratet for Fødevarer og Veterinær (DGAV) og National Instit…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denne artikel blev finansieret af projektet POCI-01-0145-FEDER-029947 “Chronic wasting disease risk assessment in Portugal” støttet af FCT (Fundação para a Ciência e a Tecnologia) – FEDER -Balcão2020. Også forfatterne af forskningsenheden CECAV modtog finansiering fra FCT under projektet UIDB / CVT / 0772/2020.Vi takker Bruce C. Campbell, forskningsdirektør (pensioneret), Western Regional Research Center, USDA, for hans hjælp.
Materials
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase |
Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use |
||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum |
Gibco |
16050-122 |
Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. |
||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. |
||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
References
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. – Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).

