Waterstofproductie en -gebruik in een membraanreactor
Summary
Membraanreactoren maken hydrogenering in omgevingsomstandigheden mogelijk zonder directe H2-input . We kunnen de waterstofproductie en -gebruik in deze systemen volgen met behulp van atmosferische massaspectrometrie (atm-MS) en gaschromatografie massaspectrometrie (GC-MS).
Abstract
Industriële hydrogenering verbruikt jaarlijks ~ 11 Mt van fossiel afgeleid H2-gas . Onze groep vond een membraanreactor uit om de noodzaak om H2-gas te gebruiken voor hydrogeneringschemie te omzeilen. De membraanreactor haalt waterstof uit water en drijft reacties aan met behulp van hernieuwbare elektriciteit. In deze reactor scheidt een dun stukje Pd een elektrochemisch waterstofproductiecompartiment van een chemisch hydrogeneringscompartiment. De Pd in de membraanreactor fungeert als (i) een waterstofselectief membraan, (ii) een kathode en (iii) een katalysator voor hydrogenering. Hierin rapporteren we het gebruik van atmosferische massaspectrometrie (atm-MS) en gaschromatografie massaspectrometrie (GC-MS) om aan te tonen dat een toegepaste elektrochemische bias over een Pd-membraan efficiënte hydrogenering mogelijk maakt zonder directe H2-invoer in een membraanreactor. Met atm-MS hebben we een waterstofpermeatie van 73% gemeten, waardoor de hydrogenering van propiofenon tot propylbenzeen met 100% selectiviteit mogelijk werd, zoals gemeten door GC-MS. In tegenstelling tot conventionele elektrochemische hydrogenering, die beperkt is tot lage concentraties uitgangsmateriaal opgelost in een proprotische elektrolyt, maakt de fysische scheiding van waterstofproductie en gebruik in de membraanreactor hydrogenering in elk oplosmiddel of bij elke concentratie mogelijk. Het gebruik van hoge concentraties en een breed scala aan oplosmiddelen is bijzonder belangrijk voor de schaalbaarheid van reactoren en toekomstige commercialisering.
Introduction
Thermochemische hydrogeneringsreacties worden gebruikt in ~20% van alle chemische synthese1. Deze reacties vereisen grote hoeveelheden H 2-gas, die meestal afkomstig zijn van fossiele brandstoffen, temperaturen tussen 150 °C en 600 °C en drukken tot 200 atm2. Elektrochemische hydrogenering is een aantrekkelijke manier om deze vereisten te omzeilen en hydrogeneringsreacties te stimuleren met behulp van water en hernieuwbare elektriciteit3. Voor conventionele elektrochemische hydrogenering wordt een onverzadigde grondstof opgelost in een protische elektrolyt in een elektrochemische cel. Wanneer een potentiaal op de cel wordt toegepast, vindt wateroxidatie plaats aan de anode, terwijl hydrogenering optreedt bij de kathode. In deze reactieopstelling vinden zowel elektrochemische wateroxidatie als chemische hydrogenering plaats in dezelfde reactieomgeving. Het organische substraat wordt opgelost in een protische elektrolyt om zowel elektrochemische watersplitsing als hydrogenering van de grondstof mogelijk te maken. De nabijheid van deze reacties kan leiden tot bijproductvorming en elektrodevervuiling wanneer de reactant gevoelig is voor nucleofiele aanval of als de reactantconcentratie te hoog is (>0,25 M)4.
Deze uitdagingen brachten onze groep ertoe om alternatieve manieren te onderzoeken om hydrogeneringsreacties elektrochemisch aan te sturen 5,6,7. Deze zoektocht resulteerde in het gebruik van een Pd-membraan, dat conventioneel wordt gebruikt in waterstofgasscheiding8. We gebruiken het als elektrode voor waterelektrolyse aan de kant van de elektrochemische reactor. Deze nieuwe toepassing van een palladiummembraan maakt de fysieke scheiding van de plaats van elektrochemische wateroxidatie van de plaats van chemische hydrogenering mogelijk. De resulterende reactorconfiguratie heeft twee compartimenten: 1) een elektrochemisch compartiment voor waterstofproductie; en 2) een chemisch compartiment voor hydrogenering (figuur 1). Protonen worden gegenereerd in het elektrochemische compartiment door een potentiaal aan te brengen over de Pt-anode en het Pd-membraan, dat ook als kathode dient. Deze protonen migreren vervolgens naar het Pd-membraan, waar ze worden gereduceerd tot aan het oppervlak geadsorbeerde waterstofatomen. Het elektrochemische compartiment kan worden onderverdeeld met een optioneel kationenuitwisselingsmembraan om deze protonenmigratie te vergemakkelijken. De aan het oppervlak geadsorbeerde waterstofatomen doordringen de interstitiële octaëdrische plaatsen van het Pd fcc-rooster9 en komen tevoorschijn aan de andere kant van het membraan in het hydrogeneringscompartiment, waar ze reageren met de onverzadigde bindingen van een bepaalde grondstof om gehydrogeneerde producten te vormen 7,10,11,12,13,14,15,16. De Pd in de membraanreactor fungeert daarom als (i) een waterstofselectief membraan, (ii) een kathode en (iii) een katalysator voor hydrogenering.
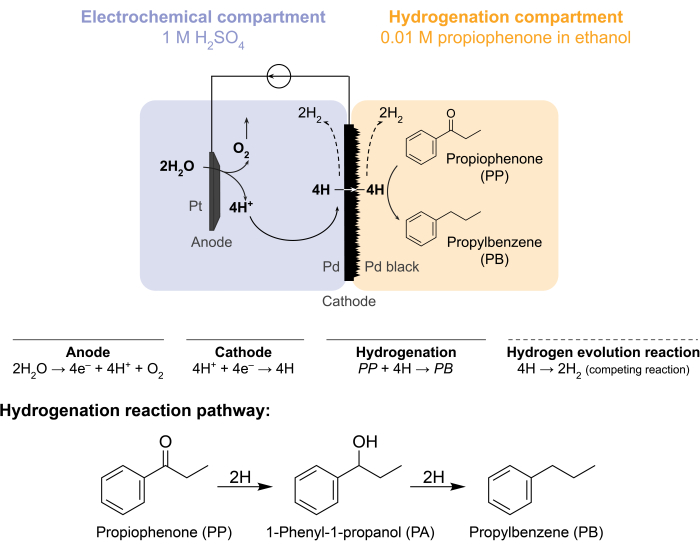
Figuur 1: Hydrogenering in een membraanreactor. Wateroxidatie aan de anode produceert protonen, die op de palladiumkathode worden verminderd. H dringt door het PD-membraan en reageert met propiofenon tot propylbenzeen. Waterstofevolutie is een concurrerende reactie die aan weerszijden van het palladiummembraan kan optreden. Voor atmosferische massaspectrometrie wordt geen chemische grondstof gebruikt, waardoor H de reactor in de vorm van H2-gas in de elektrochemische of hydrogeneringscompartimenten moet verlaten. Klik hier om een grotere versie van deze figuur te bekijken.
De membraanreactor wordt geassembleerd door een Pd-membraan tussen de anode- en kathodecompartimenten van een elektrochemische H-cel12 te sandwichen. Chemisch bestendige O-ringen worden gebruikt om het membraan op zijn plaats te houden en een lekvrije afdichting te garanderen. Het elektrochemische compartiment van de membraanreactor bevat een waterstofrijke waterige oplossing. In deze studie gebruiken we 1 M H 2 SO4 en een anode die bestaat uit een Pt-draad gehuld in een 5 cm2stuk platina gaas. De anode wordt ondergedompeld in de elektrolytoplossing door een gat in de bovenkant van het elektrochemische compartiment. Het chemische hydrogeneringscompartiment bevat een oplosmiddel- en hydrogeneringsgrondstof 7,10,11,12,16,17. Het gat aan de bovenkant van het H-celcompartiment wordt gebruikt voor bemonstering. De hier getoonde experimenten gebruiken 0,01 M propiofenon in ethanol als hydrogeneringsvoer. Het uitgangsmateriaal (en de concentratie) kunnen echter worden gevarieerd om aan de experimentele behoeften te voldoen. Een uitgangsmateriaal dat een lange koolwaterstofketen en een alkyn-functionele groep bevat, kan bijvoorbeeld worden opgelost in pentaan om de oplosbaarheidte verbeteren 11. De toegepaste stroom voor de reactie kan tussen 5 mA/cm 2 en 300 mA/cm2 liggen. Alle reacties worden uitgevoerd onder omgevingstemperatuur en druk.
Atmosferische massaspectrometrie (atm-MS) wordt gebruikt om het percentage waterstof in het elektrochemische compartiment te meten dat doordringt tot het hydrogeneringscompartiment11,12. Deze meting is belangrijk om de energie-input te begrijpen die nodig is voor de membraanreactor, omdat het het maximaal mogelijke waterstofgebruik onthult (d.w.z. hoeveel van de geproduceerde waterstof daadwerkelijk kan worden gebruikt voor hydrogeneringsreacties). Waterstofpermeatie door het Pd-membraan wordt berekend door de hoeveelheid H2 te meten die evolueert uit zowel het elektrochemische als het hydrogeneringscompartiment11,12. Een permeatiewaarde van 100% betekent dat alle waterstof die in het elektrochemische compartiment wordt geproduceerd, door het Pd-membraan naar het hydrogeneringscompartiment wordt getransporteerd en vervolgens combineert tot waterstofgas. Een permeatiewaarde van <100% betekent dat waterstofevolutie plaatsvindt in het elektrochemische compartiment voordat het door het membraan dringt. Omdat H2 wordt geproduceerd uit het elektrochemische of hydrogeneringscompartiment, komt het in het instrument en wordt het geïoniseerd tot H2+. De quadrupool selecteert fragmenten van m/z = +2, en de bijbehorende lading wordt gemeten door de detector. De plot die door deze techniek wordt verkregen, is de ionische lading in de tijd. De ionische lading wordt eerst gemeten voor het hydrogeneringscompartiment en wanneer het signaal stabiliseert, worden de kanalen veranderd om het elektrochemische compartiment te meten. Waterstofpermeatie wordt berekend door de gemiddelde ionische lading in het hydrogeneringscompartiment te delen door de totale ionische lading gemeten in de reactor (vergelijking 1)11,12. Om waterstofpermeatie te berekenen, wordt H2 uit de hydrogenerings- en elektrochemische compartimenten afzonderlijk gemeten met behulp van atm-MS.
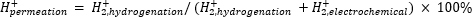 (Eq. 1)
(Eq. 1)
Gaschromatografie massaspectrometrie (GC-MS) wordt gebruikt om de voortgang van de hydrogeneringsreactie te volgen12,14,15,16. Om gegevens voor het voorbeeld te verzamelen, is het hydrogeneringscompartiment van de reactor gevuld met 0,01 M propiofenon in ethanol. Door een potentiaal over de Pt-anode en de Pd-kathode aan te brengen, wordt reactieve waterstof aan het hydrogeneringscompartiment geleverd. De reactieve waterstofatomen hydrogeneren vervolgens de onverzadigde grondstof en de producten worden gekwantificeerd met behulp van GC-MS, waarbij het monster wordt gefragmenteerd en geïoniseerd. Door de massa van deze fragmenten te analyseren, kan de samenstelling van de hydrogeneringsoplossing worden bepaald en kunnen reactiesnelheden worden berekend12,14,15,16.
Protocol
Representative Results
Discussion
Het PD-membraan maakt waterstofpermeatie en chemische hydrogenering mogelijk. De bereiding van dit membraan is daarom belangrijk voor de efficiëntie van de membraanreactor. De Pd-membraangrootte, kristallografie en het oppervlak zijn afgestemd om de experimentele resultaten te verbeteren. Hoewel Pd-metaal waterstof bij elke dikte kan ontwikkelen, worden de Pd-membranen gewalst tot 25 μm. Deze standaardisatie van membraandikte zorgt ervoor dat de tijd die waterstof nodig heeft om door het membraan te dringen constant is…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We zijn de Canadian Natural Sciences and Engineering Research Council (RGPIN-2018-06748), de Canadian Foundation for Innovation (229288), het Canadian Institute for Advanced Research (BSE-BERL-162173) en Canada Research Chairs dankbaar voor financiële steun. Dit onderzoek werd mede mogelijk gemaakt dankzij financiering van het Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. We bedanken Ben Herring van de UBC Shared Instrument Facility voor hulp bij de ontwikkeling van het GC-MS-instrument en de methode. Wij danken Dr. Monika Stolar voor haar bijdragen aan de ontwikkeling en redactie van dit manuscript. Tot slot bedanken we de hele Berlinguette Group van de Universiteit van British Columbia voor hun voortdurende steun en samenwerking bij het bestuderen van de membraanreactor.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

