عزل وتوصيف واستخلاص الحمض النووي الكلي لتحديد الفطريات الداخلية في النباتات الفطرية ذاتية التغذية
Summary
تهدف المقالة الحالية إلى توفير بروتوكولات مفصلة وكافية لعزل الفطريات الداخلية المرتبطة بالنباتات ، والحفاظ على العزلات على المدى الطويل ، والتوصيف المورفولوجي ، واستخراج الحمض النووي الكلي لتحديد الجزيئات اللاحقة والتحليلات الميتاجينومية.
Abstract
تمثل النباتات الفطرية التغذية واحدة من أكثر أشكال الاعتماد على الفطريات تطرفا ، بعد أن فقدت قدرتها الذاتية التغذية تماما. لا تقل أهمية عن أي مورد حيوي آخر ، فإن الفطريات التي ترتبط بها هذه النباتات ارتباطا وثيقا ضرورية لها. ومن ثم ، فإن بعض التقنيات الأكثر صلة في دراسة الأنواع الفطرية غير المتجانسة هي تلك التي تمكن من التحقيق في الفطريات المرتبطة بها ، وخاصة تلك التي تعيش في الجذور والأعضاء الجوفية. في هذا السياق ، يتم تطبيق تقنيات لتحديد الفطريات الداخلية المعتمدة على الثقافة والمستقلة عن الثقافة. يوفر عزل النباتات الداخلية الفطرية وسيلة لتحديدها شكليا ، وتحليل تنوعها ، والحفاظ على اللقاح للتطبيقات في الإنبات التكافلي لبذور الأوركيد. ومع ذلك ، فمن المعروف أن هناك مجموعة كبيرة ومتنوعة من الفطريات غير القابلة للزراعة التي تعيش في الأنسجة النباتية. وبالتالي ، فإن تقنيات التحديد الجزيئي المستقلة عن الثقافة توفر غطاء أوسع لتنوع الأنواع ووفرتها. تهدف هذه المقالة إلى توفير الدعم المنهجي اللازم لبدء إجراءين للتحقيق: إجراء يعتمد على الثقافة والآخر مستقل. فيما يتعلق بالبروتوكول المعتمد على الاستزراع ، يتم تفصيل عمليات جمع العينات النباتية وصيانتها من مواقع التجميع إلى مرافق المختبر ، جنبا إلى جنب مع عزل الفطريات الخيطية من الأعضاء الجوفية والجوية للنباتات الفطرية ذاتية التغذية ، والحفاظ على مجموعة من العزلات ، وتوصيف الخيوط شكليا من خلال منهجية زراعة الشرائح ، والتحديد الجزيئي للفطريات عن طريق الاستخراج الكلي للحمض النووي. وتشمل الإجراءات التفصيلية، التي تشمل منهجيات مستقلة عن الاستزراع، جمع عينات نباتية للتحليلات الميتاجينومية واستخراج الحمض النووي الكلي من الأعضاء النباتية الأكلوروفيلية باستخدام مجموعة تجارية. وأخيرا، تقترح أيضا بروتوكولات الاستمرارية (مثل تفاعل البوليميراز المتسلسل [PCR]، والتسلسل) للتحليلات، وتعرض التقنيات هنا.
Introduction
الفطريات الداخلية هي ، بحكم تعريفها ، تلك التي تعيش داخل الأعضاء والأنسجة النباتية في حالات العدوى غير الواضحة (أي دون التسبب في ضرر لمضيفها)1,2. يمكن أن تتفاعل هذه الفطريات بشكل محايد أو مفيد مع النباتات المضيفة ، وقد تمنح مقاومة لمسببات الأمراض والظروف البيئية غير المواتية ، وقد تساهم في تخليق المركبات المفيدة للنبات (على سبيل المثال ، عوامل النمو والهرمونات النباتية الأخرى)1,3. النباتات الداخلية الفطرية هي الفطريات التي تنشئ ارتباطات جذرية مع النبات ، وتشارك في نقل المغذيات4. في Orchidaceae ، يعد التفاعل مع النباتات الداخلية الفطرية أمرا أساسيا لإنبات البذور في الغالبية العظمى من الأنواع ، وإنشاء الشتلات في جميع النباتات في العائلة5. في مثل هذه السياقات ، تمثل بساتين الفاكهة الفطرية حالة من الاعتماد الكلي فيما يتعلق بشركائها الفطريين ، لأنها تعتمد على المغذيات المعدنية ونقل مركبات الكربون بواسطة هذه الفطريات خلال دورة حياتها بأكملها6. لذلك ، فإن عزل وتحديد الفطريات المرتبطة هو قاعدة أساسية عند التحقيق في استراتيجيات الحياة الفطرية. علاوة على ذلك ، لا يعرف سوى القليل عن أدوار النباتات الداخلية الفطرية في النباتات الفطرية أو حتى التنوع الحقيقي لهذه الفطريات 7,8.
يمكن إجراء التحقيق في الفطريات الداخلية من خلال تقنيات مختلفة ، توصف تقليديا بأنها مستقلة عن الثقافة أو تعتمد ، على سبيل المثال: (أ) الملاحظة المباشرة ، (ب) العزل الفطري والتحديد المورفولوجي و / أو الجزيئي ، و (ج) استخراج الحمض النووي الكلي للأنسجة النباتية والتحديد الجزيئي9. في الملاحظة المباشرة (أ) ، يمكن فحص الفطريات الداخلية أثناء وجودها في داخل الخلايا والأنسجة النباتية بواسطة المجهر الضوئي أو الإلكتروني9 ، حيث تم تفصيل بروتوكولات الفحص المجهري المختلفة بواسطة Pena-Passos et al.10. من خلال طرق العزل (ب) ، يمكن وصف النباتات الداخلية الفطرية وفقا لمستعمراتها ، والخيوط ، ومورفولوجيا البنية الإنجابية أو المقاومة. أيضا ، من خلال تقنيات العزل ، من الممكن إجراء التحديد الجزيئي للعزلات من خلال استخراج الحمض النووي ، وتضخيم تسلسلات التعريف الجزيئي (الرموز الشريطية أو بصمات الأصابع) ، والتسلسل11. تتيح التقنية الأخيرة (ج) التحديد الجزيئي للفطريات الداخلية لكل استخراج الحمض النووي أثناء وجودها في داخل الأنسجة النباتية (metabarcoding) ، تليها إعداد المكتبة والتسلسل12.
علاوة على ذلك ، يمكن تطبيق العزلات الفطرية في تجارب الإنبات التكافلية ، باستخدام بذور من بساتين الفاكهة ذاتية التغذية أو الفطرية. مثال على هذا التطبيق هو التحقيق الذي أجراه Sisti et al.13 ، واصفا الإنبات والمراحل الأولية لتطور البروتوكورم في Pogoniopsis schenckii ، وهي سحلية فطرية التغذية ، بالاشتراك مع بعض عزلاتها ، والتي تضم الفطريات الداخلية غير الفطرية. تم تفصيل بروتوكول الإنبات التكافلي المطبق وتقديمه في مقطع فيديو بواسطة Pena-Passos et al.10. يسمح عزل الفطريات بالاشتراك مع أعضاء نباتية مختلفة بتركيز متنوع على طبيعة التفاعلات الفطرية النباتية (على سبيل المثال ، لفهم الجوانب البيئية أو الفسيولوجية للارتباط ، بالإضافة إلى التحقيقات في انتقال المغذيات من الفطريات إلى النبات)9.
تستند المنهجيات المعروضة في القسم 1 إلى مجموعة من عينات الأعضاء الجوفية ، حيث أن هذه الأعضاء تمثل أكبر الصعوبات في الجمع ، وهي ذات أهمية كبيرة لأن النباتات الداخلية الفطرية تستعمرها. ومع ذلك ، يمكن تطبيق كلا البروتوكولين المشمولين (الخطوتان 1.1 و 1.2) على أعضاء نباتية أخرى متغايرة التغذية (مثل الجذور والسيقان الزهرية والفواكه). تم تصميم منهجية الجمع الموصوفة في الخطوة 1.1 لعزل الفطريات الداخلية (القسم 2) للتوصيف المورفولوجي (القسمان 4 و 5) و / أو استخراج الحمض النووي الكلي لتحديد العزلة (القسم 6). من ناحية أخرى ، تم تعيين منهجية الجمع الموضحة في الخطوة 1.2 حصريا لاستخراج الحمض النووي الكلي للأنسجة النباتية لتقنيات metabarcoding (القسم 7). في القسم 3 ، يتم تقديم أربع طرق لتخزين الفطريات الخيطية وحفظها ، اثنتان للتخزين قصير الأجل (3-6 أشهر) والطريقتان الأخريان كافيتان للتخزين طويل الأجل (>1 سنة). قد يرتبط التوصيف المورفولوجي (القسمان 4 و 5) بالتحديد الجزيئي لتعزيزه وتوفير معلومات مهمة عن التشكل الكلي والدقيق الفطري. ويلخص الشكل 1 المنهجيات الجماعية الموصوفة بعد ذلك.
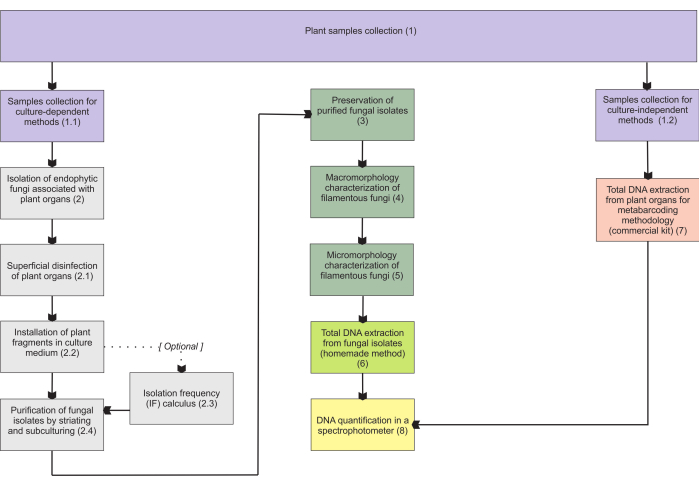
الشكل 1: تلخيص تخطيطي للطرق المقدمة. جمع النباتات وعزلها الفطري وحفظها وتحديدها الجزيئي من خلال منهجيات تعتمد على الثقافة ومستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
يعد التطهير السطحي للعينات النباتية أحد أهم المراحل في البروتوكول المقدم. لا تلوث في أطباق المساعد الشخصي الرقمي مع قطرات من الغسيل الأخير أمر مرغوب فيه للغاية. كثيرا ما يتم ملاحظة البكتيريا كملوثات في أطباق العزل ، وعادة ما تكون أكثر من الفطريات المبوغة المحمولة جوا ، مع الأخذ في الاعتبا…
Divulgations
The authors have nothing to disclose.
Acknowledgements
نشكر التمويل من FAPESP (2015/26479-6) و CNPq (447453/2014-9). تشكر JLSM CNPq على منح الإنتاجية (303664 / 2020-7). MPP يشكر Capes (منحة درجة الماجستير ، العملية 88887.600591 / 2021-00) و CNPq.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

