Isolering, karakterisering og total DNA-ekstraksjon for å identifisere endofytiske sopp i mykoheterotrofe planter
Summary
Den nåværende artikkelen tar sikte på å gi detaljerte og tilstrekkelige protokoller for isolering av planteassosierte endofytiske sopp, langsiktig bevaring av isolater, morfologisk karakterisering og total DNA-ekstraksjon for påfølgende molekylær identifikasjon og metagenomiske analyser.
Abstract
Mycoheterotrophic planter presenterer en av de mest ekstreme former for mycorrhizal avhengighet, og har helt mistet sin autotrofe kapasitet. Like viktig som enhver annen viktig ressurs, er soppene som disse plantene intimt forbinder med avgjørende for dem. Derfor er noen av de mest relevante teknikkene for å studere mykoheterotrofe arter de som muliggjør undersøkelse av tilknyttede sopp, spesielt de som bor i røtter og underjordiske organer. I denne sammenheng brukes ofte teknikker for å identifisere kulturavhengige og kulturuavhengige endofytiske sopp. Isolering av soppendofytter gir et middel for morfologisk å identifisere dem, analysere deres mangfold og opprettholde inokula for applikasjoner i symbiotisk spiring av orkidéfrø. Det er imidlertid kjent at det er et stort utvalg av ikke-kulturable sopp som bor i plantevev. Dermed tilbyr kulturuavhengige molekylære identifikasjonsteknikker et bredere dekke av artsmangfold og overflod. Denne artikkelen tar sikte på å gi den metodiske støtten som er nødvendig for å starte to undersøkelsesprosedyrer: en kulturavhengig og en uavhengig. Når det gjelder den kulturavhengige protokollen, er prosessene for innsamling og vedlikehold av planteprøver fra innsamlingssteder til laboratorieanlegg detaljert, sammen med isolering av trådformede sopp fra underjordiske og luftorganer av mykoheterotrofe planter, holde en samling av isolater, morfologisk karakterisere hyfer ved lysbildekulturmetodikk og molekylær identifikasjon av sopp ved total DNA-ekstraksjon. De detaljerte prosedyrene omfatter kulturuavhengige metoder og inkluderer innsamling av planteprøver for metagenomiske analyser og total DNA-ekstraksjon fra aklorofyllløse planteorganer ved hjelp av et kommersielt sett. Til slutt foreslås også kontinuitetsprotokoller (f.eks. polymerasekjedereaksjon [PCR], sekvensering) for analyser, og teknikker presenteres her.
Introduction
Endofytiske sopp er per definisjon de som bor i det indre av planteorganer og vev i iøynefallende infeksjoner (dvs. uten å skade verten)1,2. Disse soppene kan nøytralt eller fordelaktig samhandle med vertsplanter, kan gi motstand mot patogener og ugunstige miljøforhold, og kan bidra til syntese av gunstige forbindelser for planten (f.eks. vekstfaktorer og andre fytohormoner)1,3. Mycorrhizal endofytter er sopp som etablerer mycorrhizal foreninger med planten, og deltar i næringsoverføring4. Hos Orchidaceae er samspillet med mycorrhizal endofytter grunnleggende for frøspredning hos de aller fleste arter, og frøplanteetablering i alle plantene i familien5. I slike sammenhenger representerer mykoheterotrofe orkideer et tilfelle av total avhengighet av deres mykorrhizalpartnere, da de er avhengige av mineralnæringsstoffer og overføring av karbonforbindelser av disse soppene i hele livssyklusen6. Derfor er isolering og identifisering av assosierende sopp en grunnleggende base når man undersøker mykoheterotrofe livsstrategier. Videre er lite kjent om rollene til soppendofytter i mykoheterotrofe planter eller til og med det virkelige mangfoldet av disse soppene 7,8.
Undersøkelsen av endofytiske sopp kan utføres via forskjellige teknikker, tradisjonelt beskrevet som kulturuavhengige eller -avhengige, for eksempel: (a) direkte observasjon, (b) soppisolering og morfologisk og/eller molekylær identifikasjon, og (c) total DNA-ekstraksjon av plantevev og molekylær identifikasjon9. Ved direkte observasjon (a) kan endofytiske sopp undersøkes mens de fortsatt er i det indre av planteceller og vev ved lys eller elektronmikroskopi9, da forskjellige mikroskopiprotokoller er beskrevet av Pena-Passos et al.10. Ved isolasjonsmetoder (b) kan soppendofytter karakteriseres i henhold til deres kolonier, hyfer og reproduktiv eller resistensstrukturmorfologi. Også via isolasjonsteknikker er det mulig å utføre molekylær identifikasjon av isolater gjennom DNA-ekstraksjon, amplifisering av molekylære identifikasjonssekvenser (strekkoder eller fingeravtrykk) og sekvensering11. Sistnevnte teknikk (c) muliggjør molekylær identifikasjon av endofytiske sopp per DNA-ekstraksjon mens den er i det indre av plantevev (metabarkoding), etterfulgt av bibliotekforberedelse og sekvensering12.
Videre kan soppisolater brukes i symbiotiske spiringsforsøk, ved bruk av frø fra autotrofe eller mykoheterotrofe orkideer. Et eksempel på en slik applikasjon er undersøkelsen utført av Sisti et al.13, som beskriver spiring og innledende stadier av protokormutvikling i Pogoniopsis schenckii, en mykoheterotrofisk orkidé, i forbindelse med noen av dens isolater, som omfatter ikke-mykorrhizal endofytiske sopp. Den anvendte symbiotiske spiringsprotokollen er detaljert og presentert i en video av Pena-Passos et al.10. Isolering av sopp i forbindelse med forskjellige planteorganer tillater ulike undersøkelsesfokus angående arten av plante-sopp-interaksjoner (f.eks. å forstå enten økologiske eller fysiologiske aspekter av foreningen, samt undersøkelser av næringsoverføringen fra sopp til planten)9.
Metodene som presenteres i avsnitt 1 er basert på en samling av underjordiske organprøver, da disse organene presenterer de fleste vanskeligheter med innsamling, og de er av stor interesse siden mykorrhizale endofytter koloniserer dem. Imidlertid kan begge de inkluderte protokollene (trinn 1.1 og 1.2) brukes på andre mykoheterotrofe planteorganer (f.eks. jordstengler, blomsterstengler og frukt). Innsamlingsmetodikken beskrevet i trinn 1.1 er beregnet for isolering av endofytisk sopp (pkt. 2) for morfologisk karakterisering (pkt. 4 og 5) og/eller total DNA-ekstraksjon for isolatidentifikasjon (pkt. 6). På den annen side er innsamlingsmetodikken beskrevet i trinn 1.2 utelukkende tilordnet total DNA-ekstraksjon av plantevev for metastrekkodingsteknikker (avsnitt 7). I avsnitt 3 presenteres fire metoder for lagring og konservering av trådformet sopp, to for korttidslagring (3-6 måneder) og de to andre tilstrekkelig for langtidslagring (>1 år). Den morfologiske karakteriseringen (avsnitt 4 og 5) kan være assosiert med molekylær identifikasjon for å forsterke den og gi viktig informasjon om soppmakro- og mikromorfologi. Figur 1 oppsummerer de kollektive metodene som er beskrevet deretter.
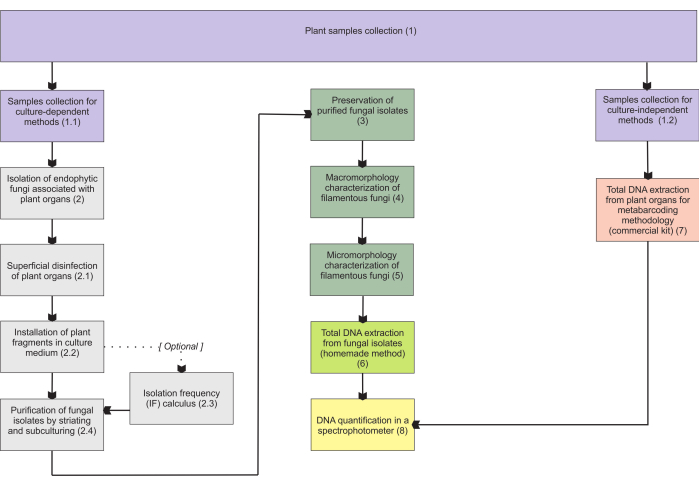
Figur 1: Skjematisk oppsummering av de presenterte metodene. Planteinnsamling og soppisolering, bevaring og molekylær identifikasjon ved kulturavhengige og -uavhengige metoder. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Den overfladiske desinfiseringen av planteprøver er et av de mest kritiske stadiene i den presenterte protokollen. Ingen forurensning i PDA-oppvasken med dråper fra siste vask er svært ønskelig. Bakterier observeres ofte som forurensninger i isolasjonsskålene, vanligvis mer enn luftbårne sporulerende sopp, med tanke på at endofytiske bakterier også er vanlige i plantevev 3,11. Dermed er tilsetning av antibiotika i kulturmediet ved installasjon av organfra…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi takker finansiering fra FAPESP (2015/26479-6) og CNPq (447453/2014-9). JLSM takker CNPq for produktivitetstilskudd (303664/2020-7). MPP takker Capes (mastergradsstipend, prosess 88887.600591/2021-00) og CNPq.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

