Hücre iskeleti ağlarının görselleştirilmesi için özelleştirilebilir, tek objektifli, ışık tabakalı floresan mikroskobunun tasarımı ve inşası
Summary
Bu protokol, tek objektifli, hafif tabakalı bir floresan mikroskobunun nasıl oluşturulacağını ve hücre iskeleti ağlarını görselleştirmek için kullanımını ayrıntılı olarak açıklar.
Abstract
Sulandırılmış hücre iskeleti kompozitleri, denge dışı yumuşak maddeyi incelemek için değerli bir model sistem olarak ortaya çıkmıştır. Bu 3D, yoğun ağların dinamiklerinin sadık bir şekilde yakalanması, genellikle floresan konfokal mikroskoplarla ilişkilendirilen optik kesit almayı gerektirir. Bununla birlikte, ışık tabakası floresan mikroskobundaki (LSFM) son gelişmeler, onu uygun maliyetli ve zaman zaman üstün bir alternatif olarak ortaya koymuştur. LSFM’yi optiğe daha az aşina olan hücre iskeleti araştırmacıları için erişilebilir kılmak için, kullanıma hazır bileşenlerden çok yönlü bir ışık tabakası floresan mikroskobu oluşturmaya yönelik adım adım bir başlangıç kılavuzu sunuyoruz. Geleneksel slayt numuneleriyle numune montajını mümkün kılmak için bu LSFM, hem uyarma hem de emisyon toplama için tek bir objektif kullanan tek objektifli ışık tabakası (SOLS) tasarımını takip eder. Okuyucuların enstrümantasyonu değiştirmesine ve kendi özel ihtiyaçlarına uyacak şekilde tasarlamasına izin vermek için SOLS’nin her bir bileşeninin işlevini yeterince ayrıntılı olarak açıklıyoruz. Son olarak, kinesin güdümlü mikrotübül ağlarında asterleri görselleştirerek bu özel SOLS cihazının kullanımını gösteriyoruz.
Introduction
Işık tabakası floresan mikroskobu (LSFM), seçici düzlem aydınlatma mikroskobu (SPIM), süpürülmüş konfokal hizalı düzlemsel uyarma (SCAPE) ve eğik düzlem mikroskobu (OPM) dahil olmak üzere, uyarma ışığının bir tabaka 1,2 şeklinde şekillendirildiği yüksek çözünürlüklü floresan görüntüleme teknikleri ailesini temsil eder3,4,5,6,7. Epi-floresan, toplam iç yansıma floresan mikroskobu (TIRFM) veya konfokal mikroskopi gibi diğer mikroskopi modalitelerinin aksine, LSFM’de fototoksisite minimumdur ve numuneler daha uzun zaman ölçeklerinde görüntülenebilir çünkü sadece aktif olarak görüntülenen numunenin düzlemi aydınlatılır 8,9,10. Bu nedenle, LSFM teknikleri, özellikle konfokal mikroskopi teknikleri için çok kalın olanlar olmak üzere, uzun süreler boyunca 3D numuneleri görüntülemek için son derece yararlıdır. Bu nedenlerden dolayı, 2004 yılındaki orijinal gelişiminden bu yana, LSFM, canlı zebra balığı ve Drosophila embriyoları gibi tüm organizmaların görselleştirilmesi için birçok fizyolog, gelişim biyoloğu ve sinirbilimci için tercih edilen görüntüleme tekniği haline gelmiştir 3,4,6,11 . Bu son yirmi yılda, LSFM’nin avantajları, hem in vivo hem de in vitro 13,14,15,17 doku11,12, hücresel ve hücre altı ölçekler dahil olmak üzere giderek daha küçük ölçeklerde yapı ve dinamikleri görselleştirmek için kullanılmıştır.
Literatürde başarılı kullanım durumlarına dair raporlara rağmen, ticari LSFM sistemlerinin yüksek maliyeti (bu yazının yazıldığı tarih itibariyle ~0,25 milyon USD)18,19 tekniğin yaygın kullanımını engellemektedir. Kendin Yap yapılarını araştırmacılar için uygun bir alternatif haline getirmek için, açık erişim çabası OpenSPIM 22 de dahil olmak üzere birden fazla derleme kılavuzu 8,13,20,21 yayınlandı. Bununla birlikte, bugüne kadar, minimum optik deneyime sahip araştırmacılar, yalnızca geleneksel slayta monte edilmiş örneklerle uyumlu olmayan daha önceki LSFM tasarımlarını kullanabilirler (Şekil 1A). Son zamanlardaki tek amaçlı, ışık sayfası (SOLS) uygulaması, hem uyarma hem de algılama için tek bir amaç kullanır (Şekil 1C), böylece uyumluluk 5,6,8,13,20 ile ilgili sınırlamanın üstesinden gelir. Bununla birlikte, SOLS tasarımının çok yönlülüğünün maliyeti, nesne düzlemini görüntüleme için kameraya aktarmak, eğmek ve yeniden görüntülemek için iki ek hedefin gerekliliği nedeniyle yapının karmaşıklığında önemli bir artıştır (Şekil 1D). Karmaşık SOLS tarzı kurulumlara erişimi kolaylaştırmak için bu makale, yalnızca giriş seviyesi bir optik kursu hakkında bilgi sahibi olan araştırmacılar için yararlı olacak slayt uyumlu bir SOLS sisteminin tasarımı, yapımı, hizalama süreci ve kullanımı hakkında adım adım kılavuz sunmaktadır.
Protokolün kendisi kısa ve öz olsa da, okuyucular tasarımın belirli bölümleri veya donanım hususları hakkında daha fazla bilgi edinmek için hazırlık adımları sırasında diğer kaynaklara başvurmalıdır. Bununla birlikte, bir okuyucu bu tasarımın özelliklerini takip etmeyi planlıyorsa, belirli optik bileşenlerin nasıl seçileceğini anlamak gerekli olmayabilir.
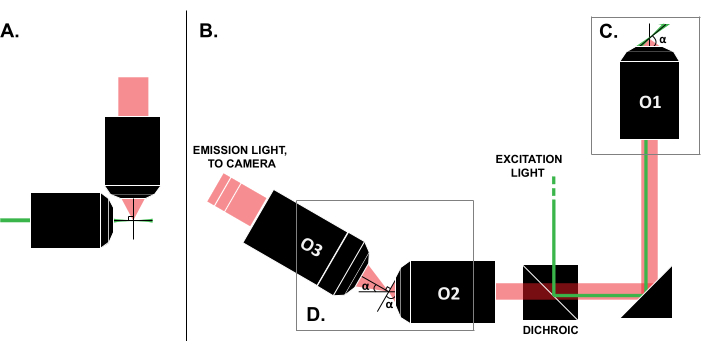
Şekil 1: Farklı LSFM konfigürasyonlarının özellikleri. (A) Erken LSFM tasarımlarında ortak olan iki ortogonal hedefe sahip kurulum. Bu konfigürasyonda, numuneyi içermek için geleneksel slayt montaj teknikleriyle uyumlu olmayan bir kılcal tüp veya bir jel silindiri kullanılır. (B) Aşağıdakileri gösteren bir SOLS ışık tabakası tasarımının şeması: (C) numune düzleminde (O1) hem uyarma hem de emisyon toplama için kullanılan tek hedef; bu, geleneksel bir kızağın üstüne monte edilmesine ve (D) SOLS emisyon yolundaki röle hedef sistemine izin verir. O2 emisyon ışığını toplar ve görüntüyü büyütür. O3, düzlemi kamera sensörüne doğru eğim açısında görüntüler. Kısaltmalar: LSFM = ışık tabakası floresan mikroskobu; SOLS = tek objektifli ışık levhası; O1-O3 = hedefler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu protokolle ilgili iki önemli ayrıntı, sistemin toplam maliyeti ve beklenen derleme ve hizalama süresidir. Kesin maliyet değişken olsa da, bu SOLS veya benzer bir DIY sisteminin toplam maliyetinin 85.000 USD aralığında olacağını rahatlıkla tahmin edebiliriz. Bu tahminin tüm bileşenlerin perakende fiyatını dikkate aldığını, bu nedenle bu genel fiyatın kullanılmış bileşenlerin tedarik edilmesiyle büyük ölçüde azaltılabileceğini not ediyoruz. Yapım süresi açısından, optik deneyimi az olan bir kullanıcının, tüm bileşenlerin mevcut ve hazır olması koşuluyla, tüm bu SOLS sistemini 1-2 ay içinde kurmasını ve hizalamasını beklemek mantıklı olacaktır. Protokolün uzunluğuna ve karmaşıklığına rağmen, video protokolüyle eşleştirilen yazılı makaledeki ayrıntı miktarının bu protokolü basit ve takip edilmesi hızlı hale getirmesi gerektiğine inanıyoruz.
Bu protokolde iki kritik adım vardır. İlk olarak, galvo’nun yerleşimi, üç ayrı 4f lens çiftinin parçası olduğu için birçok lensin yerleşimini belirler. Galvo’nun hem O1 hem de O2’nin arka odak düzlemleri ile konjuge olması ve eğim-değişmez taramayı sağlamak için doğru şekilde ortalanması çok önemlidir. İkincisi, görüntü kalitesi O2 ve O3’ün birbirine göre hizalanmasına son derece duyarlıdır. Burada, ilk olarak, O3’ün O2’ye hizalama açısının, uyarma ışık tabakasının eğimiyle eşleştiğinden ve böylece benzer şekilde eğimli FoV boyunca maksimum düz aydınlatma sağladığından emin olmak için özen gösterilmelidir. İkincisi, mümkün olduğunca geniş bir alana sahip düz bir FoV’yi korumak için O3 doğru eksenel mesafeye yerleştirilmelidir. Üçüncüsü, O2-O3 arayüzünden geçen sinyali en üst düzeye çıkarmak için O3, O2’den doğru yanal mesafeye yerleştirilmelidir.
Kullanılabilir FoV açısından, bu sistem 80 μm x 80 μm’lik bir alanda tutarlı aydınlatma ile düz, güvenilir bir alan elde etti. Bu alan, kamera tarafından sağlanan maksimum FoV’den daha küçüktür, bu nedenle kullanılabilir FoV, Şekil 13’teki sarı kutu ile gösterilir. Çözümleme gücü açısından, bu sistem, x ekseni boyunca 432 nm ve y ekseni boyunca 421 nm’lik minimum çözülebilir bir mesafe elde etti, bu da Gauss uyumlarının ortalama sigma x ve y’sinin iyi FoV’de nokta yayılma fonksiyonlarına (PSF’ler) bulunmasıyla ve iki ile çarpılmasıyla ölçüldü. Bu sistemin toplam NA açısından optimize edilmediğini not ediyoruz, yani kullanıcılar bu sistemin elde ettiğinden daha yüksek bir çözümleme gücü istiyorlarsa önemli bir iyileştirme için yer var. Bu tür SOLS yapısı için, birçoğu daha yüksek bir sistem çözünürlüğüne katkıda bulunacak, ancak daha yüksek bir maliyet, daha küçük bir FoV veya röle arayüzünde daha karmaşık hizalama teknikleri gibi dezavantajlara sahip çok sayıda uyumlu objektif seçeneği vardır 8,11,13,20. Ayrı olarak, kullanıcılar daha büyük bir FoV isterlerse, 2D taramaya izin vermek için ikinci bir galvo dahil etmek bu hedefe ulaşacaktır, ancak tasarıma entegre edilecek ek optik ve kontrol mekaniğigerektirecektir 32. Web sitemizdeki sayfada sistemde yapılan değişikliklerle ilgili daha fazla ayrıntı ve tasarım süreciyle ilgili diğer yararlı kaynaklara bağlantılar sağladık23.
Bu özel tasarım için belirli bileşenleri geliştirmenin ötesinde, bu yapıya başka yüksek çözünürlüklü mikroskopi teknikleri veya modaliteleri eklemek çok uygun olacaktır. Böyle bir gelişme, ek uyarma lazerlerinin orijinal uyarma yolu8’e hizalanmasını içeren çok dalga boylu aydınlatmayı dahil etmek olacaktır. Ayrıca, bu tür SOLS tasarımı numuneyi erişilebilir bıraktığından, mikroskoba optik cımbızlama, mikroakışkanlar ve reometri dahil ancak bunlarla sınırlı ek işlevler eklemek nispeten basittir 2,33.
Yayınlanmış sayısız ışıklı sayfa kılavuzuyla karşılaştırıldığında, bu protokol, önemli optik deneyimi olmayan bir kullanıcının yararlı bulabileceği bir anlayış düzeyinde talimatlar sağlar. Geleneksel örnek slayt montaj yeteneklerine sahip kullanıcı dostu bir SOLS yapısını daha geniş bir kitle için erişilebilir hale getirerek, cihazın kullanıldığı veya kullanılabileceği tüm alanlarda SOLS tabanlı araştırma uygulamalarının daha da genişletilmesini sağlamayı umuyoruz. 2,34,35 sayısı hızla artan SOLS enstrümanlarının uygulamalarına rağmen, SOLS tipi enstrümanların birçok faydasının ve kullanımının hala keşfedilmemiş olduğuna inanıyoruz ve bu tür enstrümanların ileriye dönük olasılıklarına heyecan duyuyoruz.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Ulusal Bilim Vakfı (NSF) RUI Ödülü (DMR-2203791) tarafından J.S.’ye desteklenmiştir. Uyum sürecinde Dr. Bin Yang ve Dr. Manish Kumar tarafından sağlanan rehberlik için minnettarız. Kinesin motorlarının hazırlık talimatları için Dr. Jenny Ross ve K. Alice Lindsay’e teşekkür ederiz.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

