Chimere antigeenreceptor T-celproductie op een geautomatiseerde celprocessor
Summary
Dit artikel beschrijft het productieproces voor chimere antigeenreceptor-T-cellen voor klinisch gebruik, met name met behulp van een geautomatiseerde celprocessor die virale transductie en kweek van T-cellen kan uitvoeren. We geven aanbevelingen en beschrijven valkuilen waarmee rekening moet worden gehouden tijdens de procesontwikkeling en implementatie van een klinische studie in een vroege fase.
Abstract
Chimere antigeenreceptor (CAR)-T-cellen vertegenwoordigen een veelbelovende immunotherapeutische benadering voor de behandeling van verschillende kwaadaardige en niet-kwaadaardige ziekten. CAR-T-cellen zijn genetisch gemodificeerde T-cellen die een chimeer eiwit tot expressie brengen dat een doelwit op het celoppervlak herkent en eraan bindt, wat resulteert in het doden van de doelcel. Traditionele productiemethoden voor CAR-T-cellen zijn arbeidsintensief, duur en kunnen het risico op besmetting met zich meebrengen. De CliniMACS Prodigy, een geautomatiseerde celprocessor, maakt het mogelijk om celtherapieproducten op klinische schaal te produceren in een gesloten systeem, waardoor het risico op besmetting wordt geminimaliseerd. De verwerking vindt semi-automatisch plaats onder controle van een computer en minimaliseert zo de menselijke betrokkenheid bij het proces, wat tijd bespaart en variabiliteit en fouten vermindert.
Dit manuscript en deze video beschrijven het T-celtransductieproces (TCT) voor het vervaardigen van CAR-T-cellen met behulp van deze processor. Het TCT-proces omvat CD4+/CD8+ T-celverrijking, activering, transductie met een virale vector, expansie en oogst. Met behulp van de Activity Matrix, een functionaliteit die het mogelijk maakt om deze stappen te ordenen en te timen, kan het TCT-proces uitgebreid worden aangepast. We geven een overzicht van de productie van CAR-T-cellen in overeenstemming met de huidige Good Manufacturing Practice (cGMP) en bespreken de vereiste afgiftetests en preklinische experimenten die een aanvraag voor een nieuw geneesmiddel (Investigational New Drug) (IND) zullen ondersteunen. We demonstreren de haalbaarheid en bespreken de voor- en nadelen van het gebruik van een semi-automatisch proces voor de productie van klinische CAR-T-cellen. Ten slotte beschrijven we een lopende, door onderzoekers geïnitieerde klinische studie die zich richt op pediatrische B-celmaligniteiten [NCT05480449] als een voorbeeld van hoe dit productieproces kan worden toegepast in een klinische setting.
Introduction
Adoptieve overdracht van T-cellen die zijn ontworpen om een chimere antigeenreceptor (CAR) tot expressie te brengen, heeft een opmerkelijke werkzaamheid aangetoond bij de behandeling van patiënten met refractaire B-celmaligniteiten 1,2,3,4,5. De traditionele productiemethoden voor CAR-T-cellen zijn echter arbeidsintensief, tijdrovend en vereisen hoogopgeleide technici om zeer gespecialiseerde stappen uit te voeren. Het traditionele productieproces van een autoloog CAR-T-celproduct omvat bijvoorbeeld dichtheidsgradiëntcentrifugatie, elutriatie of magnetische scheiding om T-cellen te verrijken, activering en transductie met een virale vector in een steriele kolf en expansie in een bioreactor voorafgaand aan de oogst en formulering. De laatste tijd zijn er verschillende systemen ontstaan die tot doel hebben dit proces gedeeltelijk te automatiseren. De Miltenyi CliniMACS Prodigy (hierna de “processor” genoemd) is bijvoorbeeld een geautomatiseerd celverwerkingsapparaat dat veel van deze stappen op een geautomatiseerde manier kan uitvoeren 6,7,8,9. Een diepgaande bespreking van traditionele en geautomatiseerde CAR-T-productiemethoden wordt gepresenteerd in een recent overzichtsartikel10.
De processor bouwt voort op de functionaliteit van de CliniMACS Plus, een door de Amerikaanse Food and Drug Administration (FDA) goedgekeurd medisch hulpmiddel voor de verwerking van hematopoëtische voorlopercellen. De processor bevat een celkweekeenheid die het mogelijk maakt om cellen automatisch te wassen, te fractioneren en te kweken (Figuur 1). Het T-celtransductieproces (TCT) is een vooraf ingesteld programma binnen het processorapparaat dat grotendeels de handmatige productie van CAR-T-cellen repliceert. TCT maakt aanpasbare celverwerking mogelijk met behulp van een grafische gebruikersinterface (de “Activity Matrix”, Figuur 2). Omdat de processor veel stappen automatiseert en de functionaliteit van meerdere apparaten in één machine consolideert, vereist het minder training en gespecialiseerde probleemoplossingsvaardigheden van technologen. Omdat alle stappen worden uitgevoerd binnen een gesloten slangenset voor eenmalig gebruik, kan de processor worden gebruikt in faciliteiten met een minder strenge luchtbehandelingsinfrastructuur dan acceptabel zou worden geacht voor een open productieproces. We werken bijvoorbeeld met de verwerker in een faciliteit die is gecertificeerd als ISO-klasse 8 (vergelijkbaar met EU-klasse C).
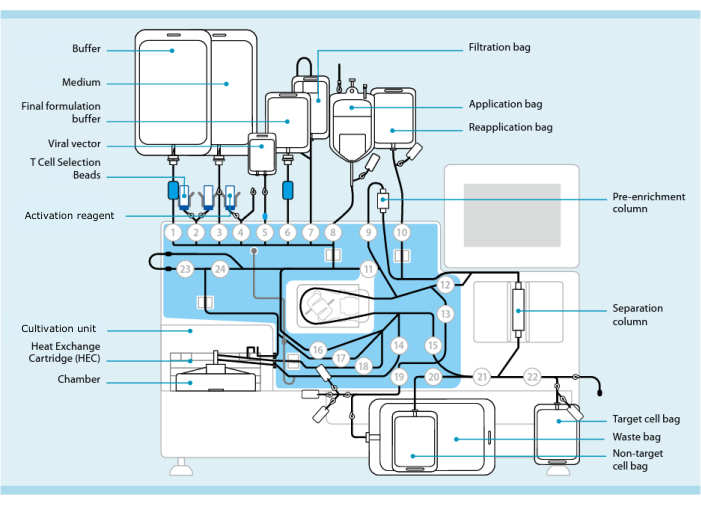
Figuur 1: Productie van CAR-T-cellen met behulp van het T-celtransductiesysteem. Afgebeeld is de processor met de slangenset geïnstalleerd. De slangenset maakt het mogelijk om andere componenten zoals zakken met verwerkingsbuffer, kweekmedium en lentivirale vector via steriel lassen met elkaar te verbinden. Zodra het leukafereseproduct aan de applicatiezak is toegevoegd, kan het worden geëtiketteerd met T-celselectieparels, door de scheidingskolom worden gehaald en vervolgens worden overgebracht naar de zak voor opnieuw aanbrengen. Geselecteerde cellen worden vervolgens naar de kweekeenheid van het kweekinstrument geleid en geactiveerd met het activeringsreagens (zie materiaaltabel). Het eindproduct wordt opgevangen in de Target cell bag. Gedurende het hele proces is het mogelijk om monsters aseptisch te verwijderen voor kwaliteitscontrole. Grijze getallen in cirkels vertegenwoordigen de genummerde kleppen op de processor die het vloeistofpad door de slangenset leiden. Gereproduceerd met toestemming van 11. Klik hier om een grotere versie van deze figuur te bekijken.
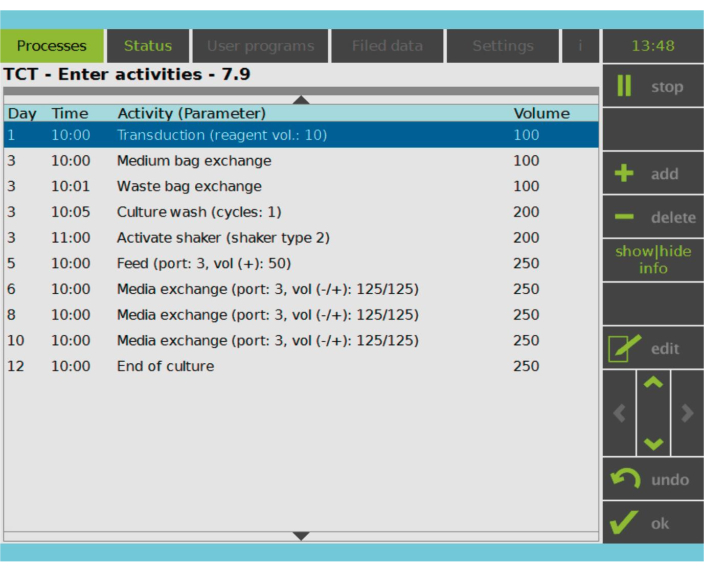
Figuur 2: Activiteitenmatrix. Na selectie en activering van de T-cel is de rest van het productieproces van de CAR-T-cel volledig aanpasbaar. Activiteiten kunnen worden toegevoegd of verwijderd en gepland voor de juiste dag en tijd, en het kweekvolume na de activiteit kan worden opgegeven (Volume). De transductieactiviteit is bijvoorbeeld geconfigureerd om op dag 1 om 10:00 uur te beginnen en het kweekvolume aan het einde van de activiteit is ingesteld op 100 ml. De Activity Matrix kan gedurende de hele teeltperiode worden bewerkt. De status van het proces kan worden bewaakt op het geïntegreerde scherm van het verwerkingsapparaat. Klik hier om een grotere versie van deze figuur te bekijken.
Het doel van dit manuscript is om een gedetailleerd overzicht te geven van de productie van CAR-T-cellen met behulp van de processor en bovendien richtlijnen te geven voor de tests tijdens het proces en de productvrijgave die waarschijnlijk door regelgevers zullen worden vereist om een aanvraag voor een nieuw geneesmiddel (IND) goed te keuren. Het gepresenteerde protocol blijft dicht bij de aanbevolen aanpak van de leverancier en is het onderliggende protocol voor IND 28617, dat momenteel wordt geëvalueerd in een door de onderzoeker geïnitieerde fase I/II klinische studie in één centrum. Deze studie heeft tot doel de veiligheid en werkzaamheid te bepalen van het gebruik van deze processor om gehumaniseerde CD19-gerichte autologe CAR-T-cellen te produceren voor patiënten met B-cel acute lymfoblastische leukemie (B-ALL) of B-lijn lymfoblastisch lymfoom (B-Lly) [NCT05480449]. De studie is gestart in september 2022 en is gepland om tot 89 patiënten in de leeftijd van 0-29 jaar in te schrijven met B-ALL of B-Lly. We rapporteren enkele productieresultaten van de proef in het manuscript.
We willen erop wijzen dat, hoewel het manuscript wordt gepresenteerd als een protocol met te volgen stappen, het moet worden beschouwd als een startpunt voor anderen om te beginnen met het optimaliseren van hun eigen CAR-T-celproductieproces. Een niet-uitputtende lijst van mogelijke variaties op het gepresenteerde protocol omvat: het gebruik van verse in plaats van gecryopreserveerde T-cellen als uitgangsmateriaal; een andere methode van T-celverrijking te gebruiken of helemaal weg te laten; het gebruik van verschillende media en cytokinecocktails zoals IL7/IL15 in plaats van IL2; de concentratie van humaan AB-serum te variëren of helemaal weg te laten; timing van transductie; het gebruik van “multi-hit”-transducties; variërende agitatie, kweekvolumes en voedingsschema; het gebruik van verschillende methoden voor genetische overdracht, waaronder elektroporatie van nucleïnezuren of niet-lentivirale vectoren; het gebruik van een andere buffer en/of cryoprotectant voor de uiteindelijke formulering; en het toedienen van verse CAR-T-cellen in plaats van cryopreservatie voor infusie op een later tijdstip. Deze variaties kunnen een aanzienlijke invloed hebben op de cellulaire samenstelling en potentie van het therapeutische product.
| Algemene processtap | Dag van het proces | Technische gegevens | |||
| Cel verrijking | Dag 0 | Selectie van CD4+/CD8+ T-cellen | |||
| Cel Activatie | Zaaien en activeren van T-celkweek | ||||
| Celtransductie | Dag 1 | Lentivirale transductie (100 ml kweekvolume) | |||
| Celexpansie (gevolgd door celformulering) | Dag 2 | — | |||
| Dag 3 | Culture Wash (1 cyclus); Shaker geactiveerd; Kweekvolume neemt toe tot 200 ml | ||||
| Dag 4 | — | ||||
| Dag 5 | Voer (50 ml); Het kweekvolume bereikt het uiteindelijke volume van 250 ml | ||||
| Dag 6 | Monster in proces; Media-uitwisseling (-125 ml / +125 ml) | ||||
| Dag 7 | Media-uitwisseling (-150 ml / +150 ml) of oogst | ||||
| Dag 8 | Monster in proces; Media-uitwisseling (-150 ml / +150 ml) of oogst | ||||
| Dag 9 | Media-uitwisseling (-180 ml / +180 ml) of oogst | ||||
| Dag 10 | Monster in proces; Media-uitwisseling (-180 ml / +180 ml) of oogst | ||||
| Dag 11 | Media-uitwisseling (-180 ml / +180 ml) of oogst | ||||
| Dag 12 | Media-uitwisseling (-180 ml / +180 ml) of oogst | ||||
| Dag 13 | Oogst | ||||
Tabel 1: Procestijdlijn en overzicht. Deze tabel geeft een overzicht van de TCT-processtappen die worden gebruikt in een lopend klinisch onderzoek [NCT05480449]. Het proces begint met T-celverrijking door CD4+/CD8+-selectie, kweekzaaien en activeren op dag 0, gevolgd door transductie op dag 1. Cellen rusten 48 uur, gevolgd door een kweekwassing, een verhoging van het kweekvolume tot 200 ml en agitatie met behulp van een schudmechanisme. Op dag 6 wordt het eerste procesmonster genomen. Cellen worden geoogst zodra er voldoende cellen beschikbaar zijn voor ten minste drie volledige doses CAR-T-cellen (5 × 10, 6 CAR-T-cellen/kg als de patiënt <50 kg, anders 2,5 × 10,8 CAR-T-cellen) en kwaliteitscontroletests (~2 × 10,6 CAR-T-cellen); of zodra de kweek een totaal van 4-5 x 109 cellen bereikt. Afkortingen: TCT = T-celtransductie; CAR-T = chimere antigeenreceptor T-cellen; MACS = magnetisch geactiveerde celsortering.
Protocol
Representative Results
Discussion
CAR-T-celtherapie is naar voren gekomen als een veelbelovende behandelingsbenadering voor B-cel en andere maligniteiten. Traditionele productiemethoden voor CAR-T-cellen hebben echter verschillende beperkingen, zoals hoge kosten, arbeidsintensieve productie en open stappen die het risico op besmetting vergroten. Onlangs zijn er verschillende semi-geautomatiseerde platforms, waaronder de Miltenyi CliniMACS Prodigy (de “processor”), ontstaan om deze beperkingen aan te pakken. Het T-celtransductieproces (TCT), geïntegreerd…
Divulgations
The authors have nothing to disclose.
Acknowledgements
De auteurs willen graag de bijdragen van verschillende individuen en organisaties aan dit werk erkennen. Het Cell and Gene Therapy Laboratory en het Penn Translational and Correlative Studies Laboratory hebben waardevolle hulp geboden bij de procesontwikkeling en voorbereiding op IND-indieningen. Melissa Varghese en Amanda DiNofia hebben bijgedragen aan de procesontwikkeling en voorbereiding van IND-inzendingen die ten grondslag liggen aan dit manuscript. Dit werk werd ondersteund door een Acceleration Grant van de Cell and Gene Therapy Collaborative van het Children’s Hospital of Philadelphia. De auteurs willen ook Miltenyi Biotec bedanken voor hun technische en onderzoeksondersteuning. Figuur 1 valt onder copyright © 2023 Miltenyi Biotec B.V. & Co. KG; Alle rechten voorbehouden.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

