ייצור תאי T של קולטן אנטיגן כימרי על מעבד תאים אוטומטי
Summary
מאמר זה מפרט את תהליך הייצור של תאי T קולטני אנטיגן כימריים לשימוש קליני, במיוחד באמצעות מעבד תאים אוטומטי המסוגל לבצע התמרה נגיפית וטיפוח של תאי T. אנו מספקים המלצות ומתארים מלכודות שיש לקחת בחשבון במהלך תהליך הפיתוח והיישום של ניסוי קליני בשלב מוקדם.
Abstract
תאי קולטן אנטיגן כימרי (CAR)-T מייצגים גישה אימונותרפית מבטיחה לטיפול במחלות ממאירות ולא ממאירות שונות. תאי CAR-T הם תאי T מהונדסים גנטית המבטאים חלבון כימרי המזהה ונקשר למטרה על פני התא, וכתוצאה מכך הורג את תא המטרה. שיטות ייצור מסורתיות של תאי CAR-T הן עתירות עבודה, יקרות ועלולות לשאת סיכון לזיהום. CliniMACS Prodigy, מעבד תאים אוטומטי, מאפשר לייצר מוצרי תרפיה תאית בקנה מידה קליני במערכת סגורה, תוך מזעור הסיכון לזיהום. העיבוד מתבצע באופן חצי אוטומטי בשליטת המחשב ובכך ממזער את המעורבות האנושית בתהליך, מה שחוסך זמן ומפחית שונות ושגיאות.
כתב יד וסרטון זה מתאר את תהליך התמרת תאי T (TCT) לייצור תאי CAR-T באמצעות מעבד זה. תהליך ה-TCT כולל העשרה, הפעלה והעברה של תאי T מסוג CD4+/CD8+, התמרה באמצעות וקטור נגיפי, הרחבה וקציר. באמצעות מטריצת הפעילות, פונקציונליות המאפשרת הזמנה ותזמון של שלבים אלה, ניתן להתאים אישית את תהליך TCT באופן נרחב. אנו מספקים הדרכה על ייצור תאי CAR-T בהתאם לתנאי ייצור נאותים (cGMP) הנוכחיים ודנים בבדיקות שחרור נדרשות ובניסויים פרה-קליניים שיתמכו ביישום תרופה ניסיונית חדשה (IND). אנו מדגימים את ההיתכנות ודנים ביתרונות ובחסרונות של שימוש בתהליך חצי אוטומטי לייצור תאי CAR-T קליניים. לבסוף, אנו מתארים ניסוי קליני מתמשך ביוזמת חוקר המתמקד בממאירויות של תאי B בילדים [NCT05480449] כדוגמה לאופן שבו תהליך ייצור זה יכול להיות מיושם בסביבה קלינית.
Introduction
העברה מאומצת של תאי T שהונדסו לבטא קולטן אנטיגן כימרי (CAR) הראתה יעילות יוצאת דופן בטיפול בחולים עם ממאירויות עקשניות של תאי B 1,2,3,4,5. עם זאת, שיטות הייצור המסורתיות של תאי CAR-T הן עתירות עבודה, גוזלות זמן רב, ודורשות טכנאים מיומנים מאוד לביצוע צעדים מיוחדים ביותר. לדוגמה, תהליך הייצור המסורתי של מוצר תאי CAR-T אוטולוגי כולל צנטריפוגה הדרגתית של צפיפות, אלוטריזציה או הפרדה מגנטית להעשרת תאי T, הפעלה והתמרה עם וקטור נגיפי בצלוחית סטרילית, והתפשטות בביוריאקטור לפני הקציר והפורמולציה. לאחרונה צצו מערכות שונות שמטרתן להפוך תהליך זה לאוטומטי באופן חלקי. לדוגמה, Miltenyi CliniMACS Prodigy (להלן “המעבד”) הוא מכשיר עיבוד תאים אוטומטי שיכול לבצע רבים מהשלבים הללו באופן אוטומטי 6,7,8,9. דיון מעמיק בשיטות ייצור CAR-T מסורתיות ואוטומטיות מוצג במאמר סקירה10 שפורסם לאחרונה.
המעבד מתבסס על הפונקציונליות של CliniMACS Plus, מכשיר רפואי מאושר על ידי מנהל המזון והתרופות האמריקאי (FDA) לעיבוד תאי אב המטופויטיים. המעבד כולל יחידת גידול תאים המאפשרת שטיפה, שבירה וטיפוח אוטומטיים של תאים (איור 1). תהליך התמרה של תאי T (TCT) הוא תוכנית מוגדרת מראש בתוך התקן המעבד המשחזרת במידה רבה ייצור ידני של תאי CAR-T. TCT מאפשר עיבוד תאים הניתן להתאמה אישית באמצעות ממשק משתמש גרפי (“מטריצת פעילות”, איור 2). מכיוון שהמעבד הופך שלבים רבים לאוטומטיים ומאחד את הפונקציונליות של מכשירים מרובים למחשב אחד, הוא דורש פחות הכשרה ומיומנויות מיוחדות לפתרון בעיות מטכנולוגים. מכיוון שכל השלבים מבוצעים בתוך מערכת צינורות סגורה וחד-פעמית, ניתן להפעיל את המעבד במתקנים עם תשתית טיפול באוויר פחות מחמירה מזו שנחשבת מקובלת לתהליך ייצור פתוח. לדוגמה, אנו מפעילים את המעבד במתקן המאושר כ- ISO Class 8 (דומה ל- EU grade C).
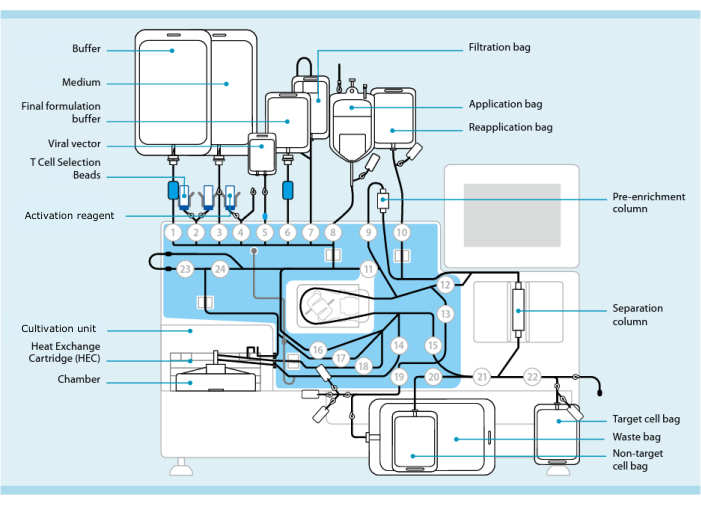
איור 1: ייצור תאי CAR-T באמצעות מערכת התמרה של תאי T. מוצג המעבד עם ערכת צינורות מותקנת. סט הצינורות מאפשר חיבור רכיבים נוספים כגון שקיות המכילות חיץ עיבוד, מדיום תרבית וקטור לנטיויראלי באמצעות ריתוך סטרילי. לאחר הוספת המוצר leukapheresis לשקית היישום, ניתן לתייג אותו בחרוזי בחירת תאי T, להעביר אותו דרך עמודת ההפרדה ולאחר מכן להעביר אותו לשקית היישום מחדש. תאים נבחרים מופנים לאחר מכן ליחידת הטיפוח של מכשיר התרבית ומופעלים באמצעות מגיב ההפעלה (ראו טבלת חומרים). המוצר הסופי נאסף בשקית תא היעד. לאורך כל התהליך ניתן להסיר דגימות לצורך בקרת איכות. מספרים אפורים בתוך עיגולים מייצגים את השסתומים הממוספרים במעבד המכוונים את נתיב הנוזל דרך מערכת הצינורות. הועתק באישור 11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
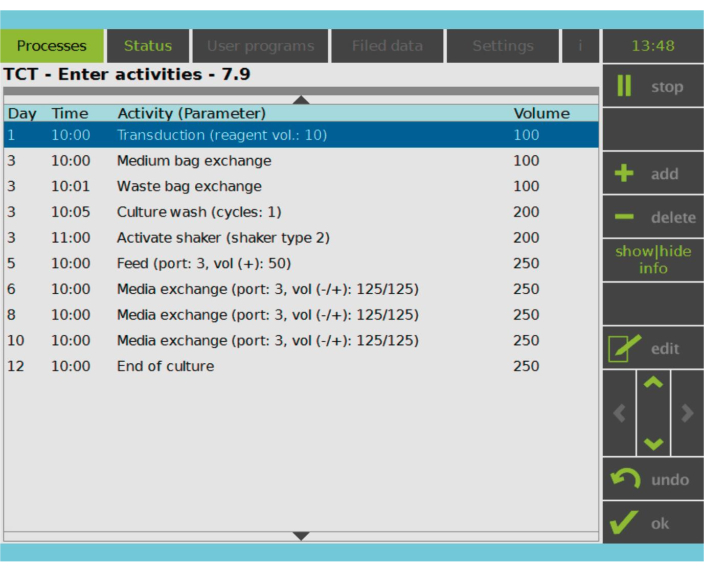
איור 2: מטריצת פעילות. לאחר הבחירה וההפעלה של תאי T, שאר תהליך הייצור של תאי CAR-T ניתן להתאמה אישית מלאה. ניתן להוסיף או למחוק פעילויות ולתזמן אותן ליום ולשעה המתאימים, וניתן לציין את נפח התרבות לאחר הפעילות (עוצמת קול). לדוגמה, פעילות הטרנסדוקציה הוגדרה להתחיל בשעה 10:00 בבוקר ביום הראשון, ונפח התרבית בסוף הפעילות הוגדר כ- 100 מ”ל. ניתן לערוך את מטריצת הפעילות לאורך כל תקופת הטיפוח. ניתן לפקח על מצב התהליך על המסך המשולב של מכשיר העיבוד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מטרת כתב היד הזה היא לספק הדרכה מפורטת על ייצור תאי CAR-T באמצעות המעבד, ובנוסף לספק הדרכה לגבי בדיקות בתהליך ושחרור המוצר, שככל הנראה יידרשו על ידי הרגולטורים כדי לאשר בקשה לתרופה ניסיונית חדשה (IND). הפרוטוקול המוצג נשאר קרוב לגישה המומלצת של הספק והוא הפרוטוקול הבסיסי עבור IND 28617, אשר נבחן כעת בניסוי קליני שלב I/II ביוזמת חוקר יחיד. ניסוי זה נועד לקבוע את הבטיחות והיעילות של השימוש במעבד זה לייצור תאי CAR-T אוטולוגיים אנושיים מכווני CD19 עבור חולים עם לוקמיה לימפובלסטית חריפה של תאי B (B-ALL) או לימפומה לימפובלסטית של שושלת B (B-Lly) [NCT05480449]. הניסוי החל בספטמבר 2022 ומתוכנן לגייס עד 89 חולים בגילאי 0-29 שנים עם B-ALL או B-Lly. אנו מדווחים על חלק מתוצאות הייצור מהניסוי בכתב היד.
ברצוננו לציין כי למרות שכתב היד מוצג כפרוטוקול עם שלבים שיש לבצע, יש לראות בו נקודת התחלה עבור אחרים להתחיל לייעל את תהליך ייצור תאי CAR-T שלהם. רשימה לא מקיפה של וריאציות אפשריות לפרוטוקול המוצג כוללת: שימוש בתאי T טריים במקום בהקפאה כחומר מוצא; שימוש בשיטה אחרת של העשרת תאי T או השמטתה לחלוטין; שימוש במדיה שונה וקוקטיילים ציטוקינים כגון IL7/IL15 במקום IL2; שינוי הריכוז של סרום AB אנושי או השמטתו לחלוטין; עיתוי ההתמרה; באמצעות תמלילים “מרובי להיטים”; תסיסה משתנה, נפחי תרבות ולוח זמנים להאכלה; שימוש בשיטות שונות של העברה גנטית כולל אלקטרופורציה של חומצות גרעין או וקטורים שאינם לנטיויראליים; שימוש במאגר פורמולציה סופית שונה ו/או בהגנה קריו-מגוננת; והחדרת תאי CAR-T טריים במקום שימור בהקפאה לעירוי במועד מאוחר יותר. לשינויים אלה עשויה להיות השפעה משמעותית על הרכב התאים ועוצמתו של המוצר הטיפולי.
| שלב התהליך הכולל | יום התהליך | פרטים טכניים | |||
| העשרת תאים | יום 0 | בחירת תאי T מסוג CD4+/CD8+ | |||
| הפעלת תאים | זריעה והפעלה של תרבית תאי T | ||||
| התמרה של תאים | יום 1 | התמרה לנטיויראלית (נפח תרבית של 100 מ”ל) | |||
| הרחבת תאים (ואחריה ניסוח תאים) | יום 2 | — | |||
| יום 3 | תרחיץ תרחיץ (מחזור אחד); שייקר הופעל; נפח התרבית גדל ל -200 מ”ל | ||||
| יום 4 | — | ||||
| יום 5 | הזנה (50 מ”ל); נפח התרבות מגיע לנפח הסופי של 250 מ”ל | ||||
| יום 6 | מדגם בתהליך; חילופי מדיה (-125 מ”ל / +125 מ”ל) | ||||
| יום 7 | החלפת מדיה (-150 מ”ל / +150 מ”ל) או קציר | ||||
| יום 8 | מדגם בתהליך; החלפת מדיה (-150 מ”ל / +150 מ”ל) או קציר | ||||
| יום 9 | החלפת מדיה (-180 מ”ל / +180 מ”ל) או קציר | ||||
| יום 10 | מדגם בתהליך; החלפת מדיה (-180 מ”ל / +180 מ”ל) או קציר | ||||
| יום 11 | החלפת מדיה (-180 מ”ל / +180 מ”ל) או קציר | ||||
| יום 12 | החלפת מדיה (-180 מ”ל / +180 מ”ל) או קציר | ||||
| יום 13 | קציר | ||||
טבלה 1: ציר הזמן של התהליך ומבט כולל. טבלה זו מסכמת את שלבי תהליך ה-TCT בהם נעשה שימוש בניסוי קליני נוכחי [NCT05480449]. התהליך מתחיל בהעשרת תאי T על ידי בחירת CD4+/CD8+, זריעת תרבית והפעלה ביום 0, ואחריו התמרה ביום 1. התאים נחים במשך 48 שעות, ולאחר מכן שטיפת תרבית, הגדלת נפח התרבית ל -200 מ”ל, ותסיסה באמצעות מנגנון טלטול. ביום 6 נלקחת הדגימה הראשונה בתהליך. תאים נקצרים ברגע שיש מספיק תאים זמינים לפחות לשלוש מנות מלאות של תאי CAR-T (5 × 106 תאי CAR-T לק”ג אם המטופל הוא <50 ק"ג, אחרת 2.5 × 108 תאי CAR-T) ובדיקות בקרת איכות (~ 2 × 106 תאי CAR-T); או ברגע שהתרבית מגיעה לסך של 4-5 x 109 תאים. קיצורים: TCT = טרנסדוקציה של תאי T; CAR-T = תאי T קולטן אנטיגן כימרי; MACS = מיון תאים המופעל באמצעות מגנטית.
Protocol
Representative Results
Discussion
טיפול בתאי CAR-T התגלה כגישה טיפולית מבטיחה עבור תאי B וממאירויות אחרות. עם זאת, לשיטות ייצור מסורתיות של תאי CAR-T יש מספר מגבלות, כגון עלות גבוהה, ייצור עתיר עבודה וצעדים פתוחים המגבירים את הסיכון לזיהום. לאחרונה, מספר פלטפורמות אוטומטיות למחצה, כולל Miltenyi CliniMACS Prodigy (“המעבד”), צצו כדי להתמודד עם מ…
Divulgations
The authors have nothing to disclose.
Acknowledgements
המחברים רוצים להכיר בתרומתם של מספר אנשים וארגונים לעבודה זו. המעבדה לתרפיה תאית וגנטית והמעבדה למחקרי תרגום וקורלציה של פן סיפקו סיוע רב ערך בפיתוח תהליכים ובהכנה להגשות IND. מליסה ורגזה ואמנדה דינופיה תרמו לתהליך, הפיתוח וההכנה להגשות IND העומדות בבסיס כתב היד הזה. עבודה זו נתמכה על ידי מענק האצה של התא ותרפיה גנטית שיתופית של בית החולים לילדים של פילדלפיה. המחברים רוצים גם להודות ל-Miltenyi Biotec על התמיכה הטכנית והמחקרית שלהם. איור 1 מכוסה על ידי זכויות יוצרים © 2023 Miltenyi Biotec B.V. &; Co. KG; כל הזכויות שמורות.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

