Produzione di cellule T del recettore dell'antigene chimerico su un processore cellulare automatizzato
Summary
Questo articolo descrive in dettaglio il processo di produzione delle cellule T del recettore dell’antigene chimerico per uso clinico, in particolare utilizzando un processore cellulare automatizzato in grado di eseguire la trasduzione virale e la coltivazione delle cellule T. Forniamo raccomandazioni e descriviamo le insidie che dovrebbero essere considerate durante lo sviluppo del processo e l’implementazione di uno studio clinico in fase iniziale.
Abstract
Le cellule T del recettore chimerico dell’antigene (CAR)-T rappresentano un promettente approccio immunoterapico per il trattamento di varie malattie maligne e non maligne. Le cellule CAR-T sono cellule T geneticamente modificate che esprimono una proteina chimerica che riconosce e si lega a un bersaglio della superficie cellulare, con conseguente uccisione della cellula bersaglio. I metodi tradizionali di produzione di celle CAR-T sono laboriosi, costosi e possono comportare il rischio di contaminazione. Il CliniMACS Prodigy, un processore cellulare automatizzato, consente di produrre prodotti per la terapia cellulare su scala clinica in un sistema chiuso, riducendo al minimo il rischio di contaminazione. L’elaborazione avviene in modo semiautomatico sotto il controllo di un computer e quindi riduce al minimo il coinvolgimento umano nel processo, risparmiando tempo e riducendo la variabilità e gli errori.
Questo manoscritto e video descrivono il processo di trasduzione delle cellule T (TCT) per la produzione di cellule CAR-T utilizzando questo processore. Il processo TCT prevede l’arricchimento, l’attivazione, la trasduzione con un vettore virale, l’espansione e la raccolta delle cellule T CD4+/CD8+. Utilizzando la Matrice delle Attività, una funzionalità che consente l’ordinamento e la tempistica di questi passaggi, il processo TCT può essere ampiamente personalizzato. Forniamo una panoramica della produzione di cellule CAR-T in conformità con le attuali buone pratiche di fabbricazione (cGMP) e discutiamo i test di rilascio richiesti e gli esperimenti preclinici che supporteranno una domanda di nuovo farmaco sperimentale (IND). Dimostriamo la fattibilità e discutiamo i vantaggi e gli svantaggi dell’utilizzo di un processo semiautomatico per la produzione clinica di cellule CAR-T. Infine, descriviamo uno studio clinico in corso avviato dallo sperimentatore che prende di mira le neoplasie pediatriche a cellule B [NCT05480449] come esempio di come questo processo di produzione possa essere applicato in un contesto clinico.
Introduction
Il trasferimento adottivo di cellule T ingegnerizzate per esprimere un recettore chimerico dell’antigene (CAR) ha mostrato una notevole efficacia nel trattamento di pazienti con neoplasie refrattarie a cellule B 1,2,3,4,5. Tuttavia, i metodi di produzione tradizionali per le celle CAR-T sono laboriosi, richiedono molto tempo e tecnici altamente qualificati per eseguire passaggi altamente specializzati. Ad esempio, il processo di produzione tradizionale di un prodotto a base di cellule CAR-T autologhe prevede la centrifugazione a gradiente di densità, l’elutriazione o la separazione magnetica per arricchire le cellule T, l’attivazione e la trasduzione con un vettore virale in un matraccio sterile e l’espansione in un bioreattore prima della raccolta e della formulazione. Recentemente sono emersi vari sistemi che mirano ad automatizzare parzialmente questo processo. Ad esempio, il Miltenyi CliniMACS Prodigy (di seguito denominato “processore”) è un dispositivo automatizzato per l’elaborazione delle cellule in grado di eseguire molti di questi passaggi in modo automatizzato 6,7,8,9. Una discussione approfondita dei metodi di produzione CAR-T tradizionali e automatizzati è presentata in un recente articolo di revisione10.
Il processore si basa sulla funzionalità di CliniMACS Plus, un dispositivo medico approvato dalla Food and Drug Administration (FDA) statunitense per l’elaborazione di cellule progenitrici ematopoietiche. Il processore include un’unità di coltivazione cellulare che consente il lavaggio, il frazionamento e la coltivazione automatizzati delle cellule (Figura 1). Il processo di trasduzione delle cellule T (TCT) è un programma preimpostato all’interno del dispositivo del processore che replica in gran parte la produzione manuale di celle CAR-T. TCT consente l’elaborazione personalizzabile delle celle utilizzando un’interfaccia utente grafica (la “Matrice delle attività”, Figura 2). Poiché il processore automatizza molti passaggi e consolida la funzionalità di più dispositivi in un’unica macchina, richiede meno formazione e competenze specializzate per la risoluzione dei problemi da parte dei tecnici. Poiché tutte le fasi vengono eseguite all’interno di un set di tubi chiuso e monouso, il processore può essere utilizzato in strutture con infrastrutture di trattamento dell’aria meno rigorose di quelle che sarebbero considerate accettabili per un processo di produzione aperto. Ad esempio, stiamo gestendo il processore in uno stabilimento certificato come ISO classe 8 (paragonabile al grado C dell’UE).
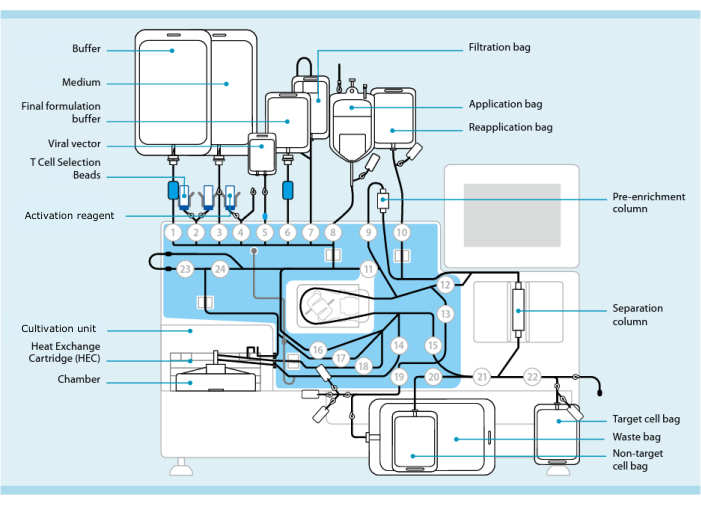
Figura 1: Produzione di cellule CAR-T utilizzando il sistema di trasduzione delle cellule T. Nell’immagine è mostrato il processore con il set di tubi installato. Il set di tubi consente di collegare altri componenti come sacche contenenti tampone di lavorazione, terreno di coltura e vettore lentivirale tramite saldatura sterile. Una volta che il prodotto per la leucoaferesi è stato aggiunto al sacchetto di applicazione, può essere etichettato con perline di selezione delle cellule T, fatto passare attraverso la colonna di separazione e quindi trasferito nel sacchetto di riapplicazione. Le cellule selezionate vengono quindi indirizzate all’unità di coltura dello strumento per la coltura e attivate con il reagente di attivazione (vedere la tabella dei materiali). Il prodotto finale viene raccolto nella sacca cellulare Target. Durante tutto il processo, è possibile prelevare i campioni per il controllo qualità in modo asettico. I numeri grigi all’interno dei cerchi rappresentano le valvole numerate sul processore che dirigono il percorso del liquido attraverso il set di tubi. Riprodotto con permesso da 11. Fare clic qui per visualizzare una versione più grande di questa figura.
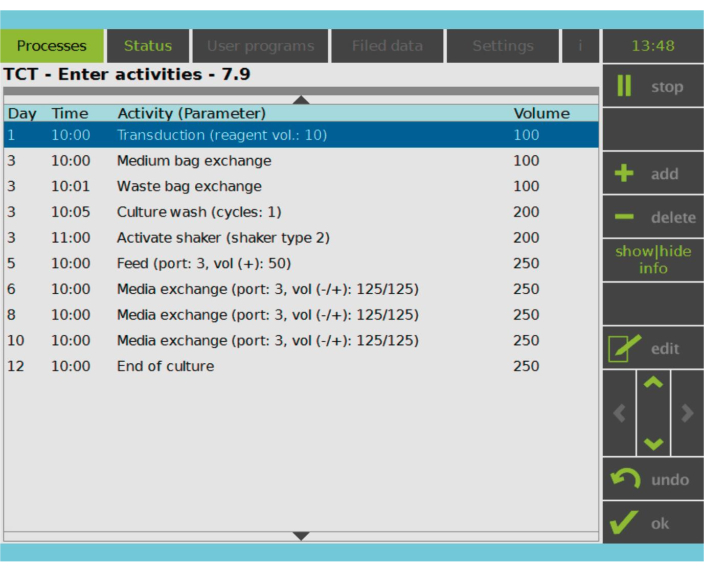
Figura 2: Matrice delle attività. Dopo la selezione e l’attivazione delle cellule T, il resto del processo di produzione delle cellule CAR-T è completamente personalizzabile. Le attività possono essere aggiunte o eliminate e pianificate per il giorno e l’ora appropriati ed è possibile specificare il volume delle impostazioni cultura dopo l’attività (Volume). Ad esempio, l’attività di trasduzione è stata configurata per iniziare alle 10:00 del giorno 1 e il volume di coltura alla fine dell’attività è stato impostato su 100 ml. La Matrice delle Attività può essere modificata durante tutto il periodo di coltivazione. Lo stato del processo può essere monitorato sullo schermo integrato del dispositivo di elaborazione. Fare clic qui per visualizzare una versione più grande di questa figura.
Lo scopo di questo manoscritto è quello di fornire una guida dettagliata alla produzione di cellule CAR-T utilizzando il processore e fornire inoltre indicazioni sui test in corso e di rilascio del prodotto che saranno probabilmente richiesti dalle autorità di regolamentazione per approvare una domanda di nuovo farmaco sperimentale (IND). Il protocollo presentato rimane vicino all’approccio raccomandato dal fornitore ed è il protocollo alla base di IND 28617, che è attualmente in fase di valutazione in uno studio clinico di fase I/II avviato da un singolo sperimentatore. Questo studio mira a determinare la sicurezza e l’efficacia dell’utilizzo di questo processore per produrre cellule CAR-T autologhe umanizzate dirette da CD19 per pazienti con leucemia linfoblastica acuta a cellule B (B-ALL) o linfoma linfoblastico di linea B (B-LLY) [NCT05480449]. Lo studio è iniziato a settembre 2022 e prevede di arruolare fino a 89 pazienti di età compresa tra 0 e 29 anni con B-ALL o B-Lly. Riportiamo nel manoscritto alcuni risultati di fabbricazione della prova.
Vorremmo sottolineare che, sebbene il manoscritto sia presentato come un protocollo con i passaggi da seguire, dovrebbe essere considerato un punto di partenza per altri per iniziare a ottimizzare il proprio processo di produzione di cellule CAR-T. Un elenco non esaustivo di possibili variazioni al protocollo presentato include: l’utilizzo di cellule T fresche invece di quelle crioconservate come materiale di partenza; l’utilizzo di un metodo diverso di arricchimento delle cellule T o l’omissione del tutto; l’utilizzo di diversi terreni e cocktail di citochine come IL7/IL15 invece di IL2; variare la concentrazione di AB sierico umano o ometterla del tutto; tempi di trasduzione; l’utilizzo di trasduzioni “multi-hit”; variare l’agitazione, i volumi di coltura e il programma di alimentazione; l’utilizzo di diversi metodi di trasferimento genetico, tra cui l’elettroporazione di acidi nucleici o vettori non lentivirali; utilizzando un tampone e/o crioprotettore di formulazione finale diverso; e l’infusione di cellule CAR-T fresche invece di crioconservarle per l’infusione in un secondo momento. Queste variazioni possono avere un impatto significativo sulla composizione cellulare e sulla potenza del prodotto terapeutico.
| Fase complessiva del processo | Giorno del processo | Dettagli tecnici | |||
| Arricchimento cellulare | Giorno 0 | Selezione di cellule T CD4+/CD8+ | |||
| Attivazione cellulare | Semina e attivazione di colture di cellule T | ||||
| Trasduzione cellulare | Giorno 1 | Trasduzione lentivirale (volume di coltura di 100 mL) | |||
| Espansione cellulare (seguita dalla formulazione cellulare) | Giorno 2 | — | |||
| Giorno 3 | Lavaggio coltura (1 ciclo); Scuotitore attivato; Il volume di coltura aumenta a 200 mL | ||||
| Giorno 4 | — | ||||
| Giorno 5 | Mangime (50 ml); Il volume di coltura raggiunge il volume finale di 250 mL | ||||
| Giorno 6 | Campione in corso di lavorazione; Scambio di terreni (-125 mL / +125 mL) | ||||
| Giorno 7 | Scambio di terreni (-150 mL / +150 mL) o Raccolta | ||||
| Giorno 8 | Campione in corso di lavorazione; Scambio di terreni (-150 mL / +150 mL) o Raccolta | ||||
| Giorno 9 | Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 10 | Campione in corso di lavorazione; Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 11 | Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 12 | Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 13 | Raccolto | ||||
Tabella 1: Sequenza temporale e panoramica del processo. Questa tabella riassume le fasi del processo TCT impiegate in uno studio clinico in corso [NCT05480449]. Il processo inizia con l’arricchimento delle cellule T mediante selezione CD4+/CD8+, semina e attivazione della coltura il giorno 0, seguito dalla trasduzione il giorno 1. Le cellule riposano per 48 ore, seguite da un lavaggio della coltura, un aumento del volume della coltura a 200 ml e agitazione mediante un meccanismo di agitazione. Il giorno 6 viene prelevato il primo campione in lavorazione. Le cellule vengono raccolte quando sono disponibili cellule sufficienti per almeno tre dosi complete di cellule CAR-T (5 × 106 cellule CAR-T/kg se il paziente pesa <50 kg, altrimenti 2,5 × 108 cellule CAR-T) e test di controllo qualità (~2 × 106 cellule CAR-T); o una volta che la coltura raggiunge un totale di 4-5 x 109 cellule. Abbreviazioni: TCT = trasduzione delle cellule T; CAR-T = cellule T chimeriche del recettore dell’antigene; MACS = selezione cellulare attivata magneticamente.
Protocol
Representative Results
Discussion
La terapia cellulare CAR-T è emersa come un approccio terapeutico promettente per le cellule B e altre neoplasie maligne. Tuttavia, i metodi tradizionali di produzione di celle CAR-T presentano diverse limitazioni, come i costi elevati, la produzione ad alta intensità di manodopera e le fasi aperte che aumentano il rischio di contaminazione. Recentemente, sono emerse diverse piattaforme semi-automatizzate, tra cui Miltenyi CliniMACS Prodigy (il “processore”), per affrontare queste limitazioni. Il processo di trasduzion…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano riconoscere il contributo di diversi individui e organizzazioni a questo lavoro. Il Laboratorio di Terapia Cellulare e Genica e il Laboratorio di Studi Traslazionali e Correlativi della Penn hanno fornito una preziosa assistenza per lo sviluppo del processo e la preparazione per le richieste di IND. Melissa Varghese e Amanda DiNofia hanno contribuito allo sviluppo del processo e alla preparazione per le presentazioni IND che sono alla base di questo manoscritto. Questo lavoro è stato sostenuto da una sovvenzione di accelerazione della Cell and Gene Therapy Collaborative del Children’s Hospital di Filadelfia. Gli autori desiderano inoltre ringraziare Miltenyi Biotec per il supporto tecnico e di ricerca. La Figura 1 è coperta da copyright © 2023 Miltenyi Biotec B.V. & Co. KG; Tutti i diritti riservati.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

