kimær antigenreseptor T-celleproduksjon på en automatisert celleprosessor
Summary
Denne artikkelen beskriver produksjonsprosessen for kimære antigenreseptor-T-celler til klinisk bruk, spesielt ved bruk av en automatisert celleprosessor som er i stand til å utføre viral transduksjon og dyrking av T-celler. Vi gir anbefalinger og beskriver fallgruver som bør vurderes under prosessutvikling og implementering av en klinisk studie i tidlig fase.
Abstract
Chimeric antigen receptor (CAR)-T-celler representerer en lovende immunterapeutisk tilnærming til behandling av ulike ondartede og ikke-ondartede sykdommer. CAR-T-celler er genetisk modifiserte T-celler som uttrykker et kimært protein som gjenkjenner og binder seg til et celleoverflatemål, noe som resulterer i drap av målcellen. Tradisjonelle CAR-T-celleproduksjonsmetoder er arbeidskrevende, dyre og kan medføre risiko for forurensning. CliniMACS Prodigy, en automatisert celleprosessor, gjør det mulig å produsere celleterapiprodukter i klinisk skala i et lukket system, noe som minimerer risikoen for kontaminering. Behandling skjer halvautomatisk under kontroll av en datamaskin og minimerer dermed menneskelig involvering i prosessen, noe som sparer tid og reduserer variasjon og feil.
Dette manuskriptet og videoen beskriver T-celletransduksjonsprosessen (TCT) for fremstilling av CAR-T-celler ved hjelp av denne prosessoren. TCT-prosessen involverer CD4 + / CD8 + T-celleanrikning, aktivering, transduksjon med en viral vektor, ekspansjon og høsting. Ved hjelp av aktivitetsmatrisen, en funksjonalitet som tillater bestilling og timing av disse trinnene, kan TCT-prosessen tilpasses omfattende. Vi gir en gjennomgang av CAR-T-celleproduksjon i samsvar med gjeldende Good Manufacturing Practice (cGMP) og diskuterer påkrevd frigjøringstesting og prekliniske eksperimenter som vil støtte en Investigational New Drug (IND) -applikasjon. Vi demonstrerer gjennomførbarheten og diskuterer fordeler og ulemper ved å bruke en halvautomatisk prosess for klinisk CAR-T-celleproduksjon. Til slutt beskriver vi en pågående utprøver-initiert klinisk studie som retter seg mot pediatriske B-celle maligniteter [NCT05480449] som et eksempel på hvordan denne produksjonsprosessen kan brukes i en klinisk setting.
Introduction
Adoptivoverføring av T-celler konstruert for å uttrykke en kimær antigenreseptor (CAR) har vist bemerkelsesverdig effekt ved behandling av pasienter med ildfaste B-cellemaligniteter 1,2,3,4,5. Imidlertid er de tradisjonelle produksjonsmetodene for CAR-T-celler arbeidskrevende, tidkrevende og krever høyt utdannede teknikere for å utføre høyt spesialiserte trinn. For eksempel involverer den tradisjonelle produksjonsprosessen av et autologt CAR-T-celleprodukt sentrifugering av tetthetsgradient, eluering eller magnetisk separasjon for å berike T-celler, aktivering og transduksjon med en viral vektor i en steril kolbe og ekspansjon i en bioreaktor før høsting og formulering. Ulike systemer har dukket opp nylig som tar sikte på å delvis automatisere denne prosessen. For eksempel er Miltenyi CliniMACS Prodigy (heretter referert til som “prosessoren”) en automatisert cellebehandlingsenhet som kan utføre mange av disse trinnene på en automatisert måte 6,7,8,9. En grundig diskusjon av tradisjonelle og automatiserte CAR-T produksjonsmetoder er presentert i en fersk gjennomgangsartikkel10.
Prosessoren bygger på funksjonaliteten til CliniMACS Plus, et amerikansk Food and Drug Administration (FDA)-godkjent medisinsk utstyr for behandling av hematopoietiske stamceller. Prosessoren inkluderer en cellekultiveringsenhet som muliggjør automatisert vasking, fraksjonering og dyrking av celler (figur 1). T-celletransduksjonsprosessen (TCT) er et forhåndsinnstilt program i prosessorenheten som i stor grad replikerer manuell CAR-T-celleproduksjon. TCT gjør det mulig å tilpasse cellebehandling ved hjelp av et grafisk brukergrensesnitt (“Activity Matrix”, figur 2). Fordi prosessoren automatiserer mange trinn og konsoliderer funksjonaliteten til flere enheter i én maskin, krever den mindre opplæring og spesialiserte feilsøkingsferdigheter fra teknikere. Fordi alle trinnene utføres innenfor et lukket slangesett til engangsbruk, kan prosessoren brukes i anlegg med mindre streng luftbehandlingsinfrastruktur enn det som anses som akseptabelt for en åpen produksjonsprosess. For eksempel bruker vi prosessoren i et anlegg sertifisert som ISO-klasse 8 (sammenlignbart med EU-grad C).
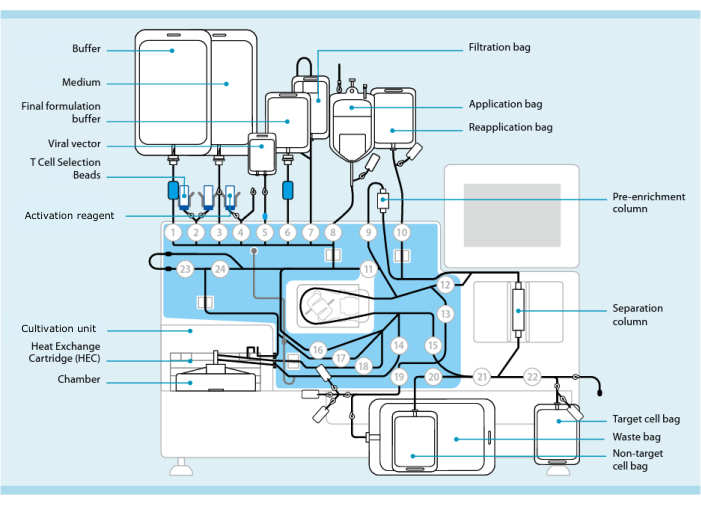
Figur 1: CAR-T-celleproduksjon ved bruk av T-celletransduksjonssystemet. Prosessoren med slangesettet installert vises. Slangesettet gjør det mulig å koble til andre komponenter som poser som inneholder prosesseringsbuffer, kulturmedium og lentiviral vektor via steril sveising. Når leukafereseproduktet er lagt til påføringsposen, kan det merkes med T-cellevalgsperler, føres gjennom separasjonskolonnen og deretter overføres til påføringsposen på nytt. Utvalgte celler blir deretter rettet til dyrkingsenheten til kulturinstrumentet og aktivert med aktiveringsreagenset (se materialtabell). Det endelige produktet samles i målcelleposen. Gjennom hele prosessen er det mulig å fjerne prøver for kvalitetskontroll aseptisk. Grå tall på innsiden av sirkler representerer de nummererte ventilene på prosessoren som leder væskebanen gjennom slangesettet. Gjengitt med tillatelse fra 11. Klikk her for å se en større versjon av denne figuren.
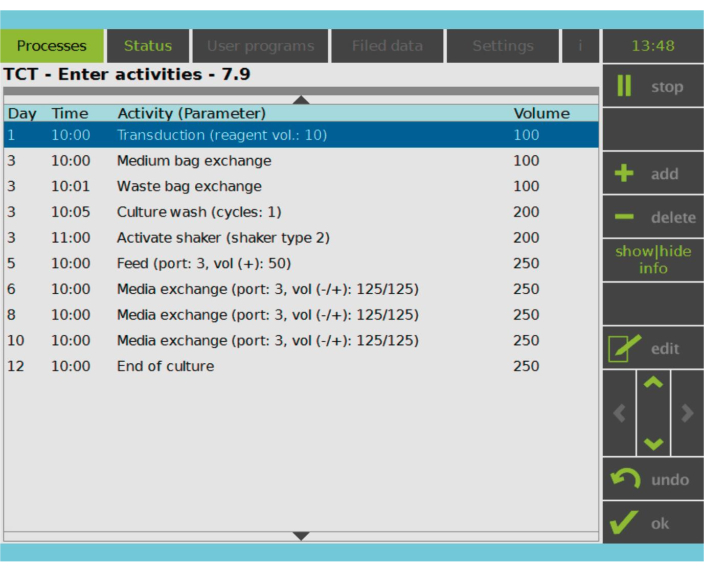
Figur 2: Aktivitetsmatrise. Etter T-cellevalg og aktivering er resten av CAR-T-celleproduksjonsprosessen fullt tilpassbar. Aktiviteter kan legges til eller slettes og planlegges for riktig dag og klokkeslett, og kulturvolumet etter aktiviteten kan spesifiseres (volum). Transduksjonsaktiviteten ble for eksempel konfigurert til å begynne klokken 10:00 på dag 1, og kulturvolumet på slutten av aktiviteten ble satt til 100 ml. Aktivitetsmatrisen kan redigeres gjennom hele dyrkingsperioden. Statusen til prosessen kan overvåkes på den integrerte skjermen til behandlingsenheten. Klikk her for å se en større versjon av denne figuren.
Målet med dette manuskriptet er å gi en detaljert gjennomgang av produksjonen av CAR-T-celler ved hjelp av prosessoren og i tillegg gi veiledning om testing i prosessen og produktutgivelsen som sannsynligvis vil bli pålagt av regulatorer for å godkjenne en undersøkelsesapplikasjon for nytt legemiddel (IND). Den presenterte protokollen holder seg nær leverandørens anbefalte tilnærming og er den underliggende protokollen for IND 28617, som for tiden evalueres i en enkeltsenter-etterforskerinitiert fase I / II klinisk studie. Denne studien tar sikte på å bestemme sikkerheten og effekten av å bruke denne prosessoren til å produsere humaniserte CD19-rettede autologe CAR-T-celler for pasienter med B-celle akutt lymfoblastisk leukemi (B-ALL) eller B-avstamning lymfoblastisk lymfom (B-Lly) [NCT05480449]. Studien startet i september 2022 og er planlagt å registrere opptil 89 pasienter i alderen 0-29 år med B-ALL eller B-Lly. Vi rapporterer noen produksjonsresultater fra forsøket i manuskriptet.
Vi vil påpeke at selv om manuskriptet presenteres som en protokoll med trinn som skal følges, bør det betraktes som et utgangspunkt for andre å begynne å optimalisere sin egen CAR-T-celleproduksjonsprosess. En ikke-omfattende liste over mulige variasjoner til den presenterte protokollen inkluderer: bruk av friske i stedet for kryopreserverte T-celler som utgangsmateriale; ved hjelp av en annen metode for T-celleberikelse eller utelatelse av den helt; bruk av forskjellige medier og cytokincocktailer som IL7 / IL15 i stedet for IL2; variere konsentrasjonen av humant AB-serum eller utelate det helt; timing av transduksjon; ved hjelp av “multi-hit” transduksjoner; varierende agitasjon, kulturvolumer og fôringsplan; bruk av forskjellige metoder for genetisk overføring, inkludert elektroporering av nukleinsyrer eller ikke-lentivirale vektorer; ved bruk av en annen endelig formuleringsbuffer og/eller kryobeskyttelsesmiddel; og infusjon av CAR-T-celler friske i stedet for kryopreserving til infusjon på et senere tidspunkt. Disse variasjonene kan ha en signifikant innvirkning på det terapeutiske produktets cellulære sammensetning og styrke.
| Overordnet prosesstrinn | Prosess dag | Tekniske detaljer | |||
| Berikelse av celler | Dag 0 | Utvalg av CD4+/CD8+ T-celler | |||
| Cell Aktivering | T-cellekultur såing og aktivering | ||||
| Cell transduksjon | Dag 1 | Lentiviviral transduksjon (100 ml dyrkningsvolum) | |||
| Celleutvidelse (etterfulgt av celleformulering) | Dag 2 | — | |||
| Dag 3 | Kultur vask (1 syklus); Shaker aktivert; Kulturvolumet øker til 200 ml | ||||
| Dag 4 | — | ||||
| Dag 5 | Fôr (50 ml); Kulturvolumet når endelig volum på 250 ml | ||||
| Dag 6 | Prøve i prosessen; Medieutveksling (-125 ml / +125 ml) | ||||
| Dag 7 | Medieutveksling (-150 ml / +150 ml) eller Harvest | ||||
| Dag 8 | Prøve i prosessen; Medieutveksling (-150 ml / +150 ml) eller Harvest | ||||
| Dag 9 | Medieutveksling (-180 ml / +180 ml) eller Harvest | ||||
| Dag 10 | Prøve i prosessen; Medieutveksling (-180 ml / +180 ml) eller Harvest | ||||
| Dag 11 | Medieutveksling (-180 ml / +180 ml) eller Harvest | ||||
| Dag 12 | Medieutveksling (-180 ml / +180 ml) eller Harvest | ||||
| Dag 13 | Høste | ||||
Tabell 1: Prosesstidslinje og oversikt. Denne tabellen oppsummerer TCT-prosesstrinnene som er brukt i en pågående klinisk studie [NCT05480449]. Prosessen starter med T-celleanrikning ved CD4+/CD8+-seleksjon, dyrkningssåing og aktivering på dag 0, etterfulgt av transduksjon på dag 1. Cellene hviler i 48 timer, etterfulgt av en kulturvask, en økning av kulturvolumet til 200 ml og omrøring ved hjelp av en ristemekanisme. På dag 6 tas den første prosessprøven. Cellene høstes når tilstrekkelige celler er tilgjengelige for minst tre fulle doser CAR-T-celler (5 × 10 6 CAR-T-celler/kg hvis pasienten er <50 kg, ellers 2,5 × 108 CAR-T-celler) og kvalitetskontrolltesting (~2 × 106 CAR-T-celler); eller når kulturen når totalt 4-5 x 109 celler. Forkortelser: TCT = T-celletransduksjon; CAR-T = kimære antigenreseptor T-celler; MACS = magnetisk aktivert cellesortering.
Protocol
Representative Results
Discussion
CAR-T celleterapi har dukket opp som en lovende behandlingsmetode for B-celle og andre maligniteter. Imidlertid har tradisjonelle CAR-T-celleproduksjonsmetoder flere begrensninger, for eksempel høye kostnader, arbeidsintensiv produksjon og åpne trinn som øker risikoen for forurensning. Nylig har flere semi-automatiserte plattformer, inkludert Miltenyi CliniMACS Prodigy (“prosessoren”), dukket opp for å løse disse begrensningene. T-celletransduksjonsprosessen (TCT), integrert i prosessoren beskrevet i dette manuskrip…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Forfatterne ønsker å anerkjenne bidragene fra flere personer og organisasjoner til dette arbeidet. Cell and Gene Therapy Laboratory og Penn Translational and Correlative Studies Laboratory ga verdifull hjelp med prosessutvikling og forberedelse til IND-innleveringer. Melissa Varghese og Amanda DiNofia har bidratt med prosessutvikling og forberedelse til IND-innleveringer som ligger til grunn for dette manuskriptet. Dette arbeidet ble støttet av et akselerasjonsstipend av celle- og genterapisamarbeidet ved Children’s Hospital of Philadelphia. Forfatterne vil også takke Miltenyi Biotec for deres tekniske og forskningsstøtte. Figur 1 er dekket av copyright © 2023 Miltenyi Biotec B.V. &; Co. KG; Alle rettigheter forbeholdt.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

