Otomatik Hücre İşlemcisinde Kimerik Antijen Reseptörü T Hücresi Üretimi
Summary
Bu makale, klinik kullanım için kimerik antijen reseptörü T hücreleri için, özellikle viral transdüksiyon ve T hücrelerinin kültivasyonunu gerçekleştirebilen otomatik bir hücre işlemcisi kullanarak üretim sürecini detaylandırmaktadır. Erken aşama bir klinik araştırmanın süreç geliştirme ve uygulaması sırasında göz önünde bulundurulması gereken önerilerde bulunuyor ve tuzakları açıklıyoruz.
Abstract
Kimerik antijen reseptörü (CAR)-T hücreleri, çeşitli malign ve malign olmayan hastalıkların tedavisi için umut verici bir immünoterapötik yaklaşımı temsil eder. CAR-T hücreleri, bir hücre yüzeyi hedefini tanıyan ve ona bağlanan ve hedef hücrenin öldürülmesiyle sonuçlanan kimerik bir proteini eksprese eden genetiği değiştirilmiş T hücreleridir. Geleneksel CAR-T hücre üretim yöntemleri emek yoğundur, pahalıdır ve kontaminasyon riski taşıyabilir. Otomatik bir hücre işlemcisi olan CliniMACS Prodigy, hücre tedavisi ürünlerinin kapalı bir sistemde klinik ölçekte üretilmesine olanak tanıyarak kontaminasyon riskini en aza indirir. İşleme, bir bilgisayarın kontrolü altında yarı otomatik olarak gerçekleşir ve böylece sürece insan katılımını en aza indirir, bu da zamandan tasarruf sağlar ve değişkenliği ve hataları azaltır.
Bu el yazması ve video, bu işlemciyi kullanarak CAR-T hücreleri üretmek için T hücresi transdüksiyon (TCT) sürecini açıklamaktadır. TCT işlemi, CD4 + / CD8 + T hücresi zenginleşmesini, aktivasyonunu, viral bir vektör ile transdüksiyonunu, genişlemesini ve hasadı içerir. Bu adımların sıralanmasına ve zamanlamasına izin veren bir işlevsellik olan Etkinlik Matrisi kullanılarak, TCT süreci kapsamlı bir şekilde özelleştirilebilir. Mevcut İyi Üretim Uygulamalarına (cGMP) uygun olarak CAR-T hücre üretiminin bir incelemesini sağlıyoruz ve bir Araştırma Amaçlı Yeni İlaç (IND) uygulamasını destekleyecek gerekli salım testlerini ve klinik öncesi deneyleri tartışıyoruz. Klinik CAR-T hücre üretimi için yarı otomatik bir süreç kullanmanın fizibilitesini gösteriyor ve avantaj ve dezavantajlarını tartışıyoruz. Son olarak, bu üretim sürecinin klinik bir ortamda nasıl uygulanabileceğinin bir örneği olarak pediatrik B hücreli maligniteleri [NCT05480449] hedefleyen, araştırmacı tarafından başlatılan devam eden bir klinik çalışmayı açıklıyoruz.
Introduction
Bir kimerik antijen reseptörünü (CAR) eksprese etmek üzere tasarlanmış T hücrelerinin evlat edinme transferi, refrakter B hücreli maligniteleriolan hastaların tedavisinde dikkate değer bir etkinlik göstermiştir 1,2,3,4,5. Bununla birlikte, CAR-T hücreleri için geleneksel üretim yöntemleri emek yoğundur, zaman alıcıdır ve son derece uzmanlaşmış adımları gerçekleştirmek için yüksek eğitimli teknisyenler gerektirir. Örneğin, otolog bir CAR-T hücre ürününün geleneksel üretim süreci, T hücrelerini zenginleştirmek için yoğunluk gradyanlı santrifüjleme, elütriasyon veya manyetik ayırma, steril bir şişede viral bir vektör ile aktivasyon ve transdüksiyon ve hasat ve formülasyondan önce bir biyoreaktörde genişlemeyi içerir. Son zamanlarda bu süreci kısmen otomatikleştirmeyi amaçlayan çeşitli sistemler ortaya çıkmıştır. Örneğin, Miltenyi CliniMACS Prodigy (bundan böyle “işlemci” olarak anılacaktır), bu adımların çoğunu otomatik bir şekildegerçekleştirebilen otomatik bir hücre işleme cihazıdır 6,7,8,9. Geleneksel ve otomatik CAR-T üretim yöntemlerinin derinlemesine bir tartışması, yakın tarihli bir inceleme makalesindesunulmuştur 10.
İşlemci, hematopoietik progenitör hücrelerin işlenmesi için ABD Gıda ve İlaç Dairesi (FDA) onaylı bir tıbbi cihaz olan CliniMACS Plus’ın işlevselliği üzerine kuruludur. İşlemci, hücrelerin otomatik olarak yıkanmasına, fraksiyonlanmasına ve yetiştirilmesine izin veren bir hücre yetiştirme ünitesi içerir (Şekil 1). T hücresi transdüksiyonu (TCT) işlemi, manuel CAR-T hücresi üretimini büyük ölçüde kopyalayan işlemci cihazı içinde önceden ayarlanmış bir programdır. TCT, grafiksel bir kullanıcı arayüzü (“Etkinlik Matrisi”, Şekil 2) kullanarak özelleştirilebilir hücre işlemeye izin verir. İşlemci birçok adımı otomatikleştirdiğinden ve birden fazla cihazın işlevselliğini tek bir makinede birleştirdiğinden, teknoloji uzmanlarından daha az eğitim ve özel sorun giderme becerileri gerektirir. Tüm adımlar kapalı, tek kullanımlık bir boru seti içinde gerçekleştirildiğinden, işlemci, açık bir üretim süreci için kabul edilebilir olarak kabul edilenden daha az sıkı hava işleme altyapısına sahip tesislerde çalıştırılabilir. Örneğin, işlemciyi ISO sınıf 8 (AB sınıfı C ile karşılaştırılabilir) sertifikalı bir tesiste çalıştırıyoruz.
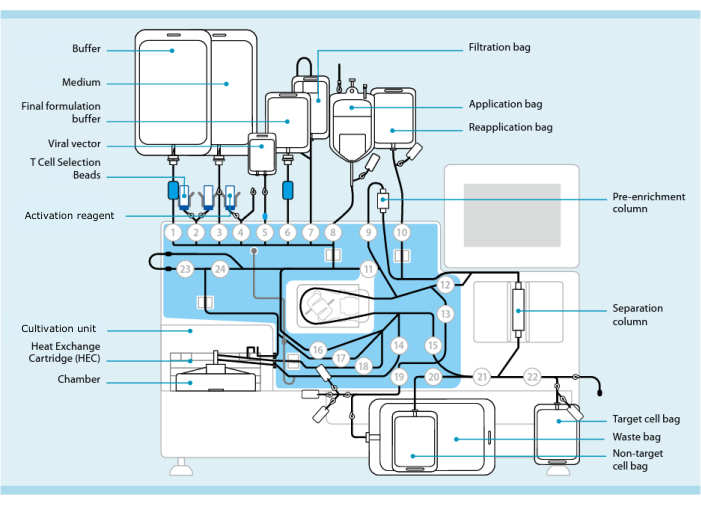
Şekil 1: T hücresi transdüksiyon sistemini kullanarak CAR-T hücresi üretimi. Gösterilen, boru setinin takılı olduğu işlemcidir. Boru seti, işleme tamponu, kültür ortamı ve lentiviral vektör içeren torbalar gibi diğer bileşenlerin steril kaynak yoluyla bağlanmasına izin verir. Lökoferez ürünü Uygulama torbasına eklendikten sonra, T Hücre Seçim Boncukları ile etiketlenebilir, Ayırma sütunundan geçirilebilir ve daha sonra Yeniden Uygulama torbasına aktarılabilir. Seçilen hücreler daha sonra kültür için aletin Yetiştirme ünitesine yönlendirilir ve Aktivasyon reaktifi ile aktive edilir (bkz. Nihai ürün, Hedef hücre torbasında toplanır. Proses boyunca, kalite kontrol için numuneleri aseptik olarak çıkarmak mümkündür. Dairelerin içindeki gri sayılar, sıvı yolunu boru setinden geçiren işlemci üzerindeki numaralı valfleri temsil eder. 11’in izniyle çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
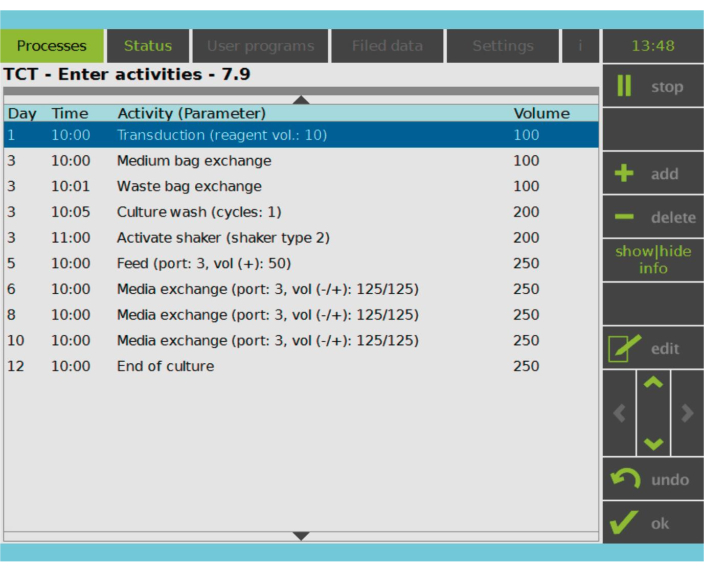
Şekil 2: Etkinlik Matrisi. T hücresi seçimi ve aktivasyonundan sonra, CAR-T hücresi üretim sürecinin geri kalanı tamamen özelleştirilebilir. Aktiviteler eklenebilir veya silinebilir ve uygun gün ve saat için planlanabilir ve aktivite sonrası kültür hacmi belirtilebilir (Hacim). Örneğin, Transdüksiyon aktivitesi 1. Gün saat 10:00’da başlayacak şekilde yapılandırıldı ve aktivitenin sonundaki kültür hacmi 100 mL olarak ayarlandı. Aktivite Matrisi, yetiştirme dönemi boyunca düzenlenebilir. İşlemin durumu, işleme cihazının entegre ekranından izlenebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu makalenin amacı, işlemciyi kullanarak CAR-T hücrelerinin üretiminin ayrıntılı bir incelemesini sağlamak ve ayrıca düzenleyiciler tarafından bir araştırma amaçlı yeni ilaç (IND) başvurusunu onaylamak için muhtemelen gerekli olacak süreç içi ve ürün salım testleri hakkında rehberlik sağlamaktır. Sunulan protokol, satıcının önerdiği yaklaşıma yakın kalır ve şu anda tek merkezli bir araştırmacı tarafından başlatılan faz I/II klinik araştırmasında değerlendirilmekte olan IND 28617’nin altında yatan protokoldür. Bu çalışma, B hücreli akut lenfoblastik lösemi (B-ALL) veya B-soy lenfoblastik lenfoma (B-Lly) hastaları için insanlaştırılmış CD19’a yönelik otolog CAR-T hücreleri üretmek için bu işlemciyi kullanmanın güvenliğini ve etkinliğini belirlemeyi amaçlamaktadır [NCT05480449]. Deneme Eylül 2022’de başladı ve B-ALL veya B-Lly ile 0-29 yaş arası 89 hastaya kadar kaydedilmesi planlanıyor. Denemeden elde edilen bazı üretim sonuçlarını makalede bildiriyoruz.
Makale, izlenecek adımları içeren bir protokol olarak sunulsa da, başkalarının kendi CAR-T hücre üretim süreçlerini optimize etmeye başlaması için bir başlangıç noktası olarak düşünülmesi gerektiğini belirtmek isteriz. Sunulan protokoldeki olası varyasyonların kapsamlı olmayan bir listesi şunları içerir: başlangıç materyali olarak dondurularak saklanmış T hücreleri yerine taze kullanılması; farklı bir T hücresi zenginleştirme yöntemi kullanmak veya tamamen atlamak; IL2 yerine IL7/IL15 gibi farklı besiyerleri ve sitokin kokteylleri kullanarak; insan AB serumunun konsantrasyonunu değiştirmek veya tamamen atlamak; transdüksiyon zamanlaması; “çok isabetli” transdüksiyonların kullanılması; değişen ajitasyon, kültür hacimleri ve beslenme programı; nükleik asitlerin veya lentiviral olmayan vektörlerin elektroporasyonu dahil olmak üzere farklı genetik transfer yöntemlerinin kullanılması; farklı bir nihai formülasyon tamponu ve/veya kriyoprotektan kullanarak; ve daha sonra infüzyon için kriyoprezervasyon yerine CAR-T hücrelerini taze olarak infüze etmek. Bu varyasyonlar, terapötik ürünün hücresel bileşimi ve gücü üzerinde önemli bir etkiye sahip olabilir.
| Genel Süreç Adımı | İşlem Günü | Teknik Detaylar | |||
| Hücre Zenginleştirme | Gün 0 | CD4+/CD8+ T hücrelerinin seçimi | |||
| Hücre Aktivasyonu | T hücre kültürü tohumlama ve aktivasyonu | ||||
| Hücre İletimi | 1. Gün | Lentiviral transdüksiyon (100 mL kültür hacmi) | |||
| Hücre Genişlemesi (ardından hücre formülasyonu) | 2. Gün | — | |||
| 3. Gün | Kültür Yıkama (1 döngü); Çalkalayıcı etkinleştirildi; Kültür hacmi 200 mL’ye yükselir | ||||
| 4. Gün | — | ||||
| 5. Gün | Besleme (50 mL); Kültür hacmi 250 mL’lik son hacme ulaşır | ||||
| 6. Gün | Proses içi numune; Medya değişimi (-125 mL / +125 mL) | ||||
| 7. Gün | Medya değişimi (-150 mL / +150 mL) veya Hasat | ||||
| 8. Gün | Proses içi numune; Medya değişimi (-150 mL / +150 mL) veya Hasat | ||||
| 9. Gün | Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 10. Gün | Proses içi numune; Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 11. Gün | Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 12. Gün | Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 13. Gün | Hasat | ||||
Tablo 1: İşlem zaman çizelgesi ve genel bakış. Bu tablo, mevcut bir klinik araştırmada kullanılan TCT süreç adımlarını özetlemektedir [NCT05480449]. İşlem, 0. günde CD4+/CD8+ seçimi, kültür tohumlaması ve aktivasyonu ile T hücresi zenginleştirmesi ile başlar, ardından 1. günde transdüksiyon ile devam eder. Hücreler 48 saat dinlenir, ardından bir kültür yıkaması, kültür hacminin 200 mL’ye çıkarılması ve bir çalkalama mekanizması kullanılarak çalkalanması gelir. 6. Günde, ilk proses içi numune alınır. Hücreler, en az üç tam doz CAR-T hücresi (hasta <50 ×kg, aksi takdirde 2,5 × 10 8 CAR-T hücresi) ve kalite kontrol testi (~2 × 106 CAR-T hücresi) için yeterli hücre mevcut olduğunda toplanır; veya kültür toplam 4-5 x 109 hücreye ulaştığında. Kısaltmalar: TCT = T hücre transdüksiyonu; CAR-T = kimerik antijen reseptörü T hücreleri; MACS = manyetik olarak etkinleştirilen hücre sıralaması.
Protocol
Representative Results
Discussion
CAR-T hücre tedavisi, B hücresi ve diğer maligniteler için umut verici bir tedavi yaklaşımı olarak ortaya çıkmıştır. Bununla birlikte, geleneksel CAR-T hücre üretim yöntemlerinin, yüksek maliyet, emek yoğun üretim ve kontaminasyon riskini artıran açık adımlar gibi çeşitli sınırlamaları vardır. Son zamanlarda, bu sınırlamaları ele almak için Miltenyi CliniMACS Prodigy (“işlemci”) dahil olmak üzere birkaç yarı otomatik platform ortaya çıktı. Bu yazıda açıklanan işlemciye entegre e…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Yazarlar, çeşitli kişi ve kuruluşların bu çalışmaya katkılarını kabul eder. Hücre ve Gen Terapisi Laboratuvarı ve Penn Translasyonel ve İlişkili Çalışmalar Laboratuvarı, süreç geliştirme ve IND sunumlarına hazırlık konusunda değerli yardımlar sağladı. Melissa Varghese ve Amanda DiNofia, bu makalenin temelini oluşturan IND sunumları için süreç geliştirme ve hazırlığa katkıda bulundular. Bu çalışma, Philadelphia Çocuk Hastanesi Hücre ve Gen Terapisi İşbirliği’nin Hızlandırma Hibesi ile desteklenmiştir. Yazarlar ayrıca teknik ve araştırma destekleri için Miltenyi Biotec’e teşekkür eder. Şekil 1 , telif hakkı © 2023 Miltenyi Biotec B.V. & Co. KG kapsamındadır; Tüm hakları saklıdır.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

