LipidUNet-Метод характеристики и количественной оценки липидных отложений с использованием пигментного эпителия сетчатки, полученного из iPSC
Summary
Дегенеративные заболевания глаз, поражающие пигментный эпителиевый слой сетчатки глаза, имеют моногенное и полигенное происхождение. Было разработано несколько моделей заболеваний и программное обеспечение LipidUNet для изучения механизмов заболевания, а также потенциальных терапевтических вмешательств.
Abstract
Пигментный эпителий сетчатки (RPE) представляет собой монослой гексагональных клеток, расположенных в задней части глаза. Он обеспечивает питание и поддержку фоторецепторов и хориоидальных капилляров, выполняет фагоцитоз наружных сегментов фоторецепторов (POS) и секретирует цитокины поляризованным образом для поддержания гомеостаза наружной сетчатки. Дисфункциональный RPE, вызванный мутациями, старением и факторами окружающей среды, приводит к дегенерации других слоев сетчатки и вызывает потерю зрения. Отличительной фенотипической особенностью дегенеративного РПЭ являются внутриклеточные и субклеточные отложения, богатые липидами. Эти отложения являются общим фенотипом при различных дегенеративных заболеваниях сетчатки. Для воспроизведения фенотипа липидного депонирования моногенных дегенераций сетчатки in vitro из фибробластов пациентов был получен индуцированный плюрипотентный RPE, полученный из стволовых клеток (iRPE). Клеточные линии, полученные от пациентов с болезнью Штаргардта и поздней дегенерацией сетчатки (L-ORD), получали POS в течение 7 дней для воспроизведения физиологической функции RPE, которая вызывала патологию, вызванную фагоцитозом POS при этих заболеваниях. Чтобы создать модель возрастной макулярной дегенерации (ВМД), полигенного заболевания, связанного с альтернативной активацией комплемента, iRPE был озадачен альтернативными анафилатоксинами комплемента. Внутриклеточные и субклеточные липидные отложения были охарактеризованы с использованием нильского красного, бор-дипиррометена (BODIPY) и аполипопротеина E (APOE). Для количественной оценки плотности отложений липидов было разработано программное обеспечение на основе машинного обучения LipidUNet. Программное обеспечение было обучено на проекционных изображениях iRPE максимальной интенсивности на культуральных поверхностях. В будущем он будет обучен анализировать трехмерные (3D) изображения и количественно определять объем липидных капель. Программное обеспечение LipidUNet станет ценным ресурсом для поиска лекарств, которые уменьшают накопление липидов в моделях заболеваний.
Introduction
Пигментный эпителий сетчатки (RPE) представляет собой монослой клеток, расположенных в задней части глаза, рядом с фоторецепторами сетчатки. RPE играет жизненно важную роль в поддержании правильного зрения, обеспечивая метаболическую и структурную поддержку фоторецепторов. Здоровые клетки RPE характеризуются отчетливой гексагональной морфологией. Они соединены плотными соединениями, которые позволяют РПЭ действовать как барьер между хориокапилляром, расположенным на его базальной стороне, и фоторецепторами, расположенными апикально. Для поддержания экосистемы сетчатки RPE перемещает ключевые метаболиты, например, глюкозу, к фоторецепторам таким образом, чтобы свести к минимуму потребление глюкозы в RPE1. Из-за этого ограничения RPE зависит от других метаболитов для поддержания своих метаболических потребностей, включая жирные кислоты, которые RPE превращает в кетоны посредством β-окисления2. Учитывая склонность RPE использовать жирные кислоты, которые, вероятно, рециркулируются в результате пищеварения внешнего сегмента фоторецепторов (POS), в качестве источника энергии, пагубные изменения в путях обработки липидов в RPE часто приводят или связаны как с моногенными, так и с полигенными дегенеративными заболеваниями сетчатки3.
Возрастная макулярная дегенерация (ВМД), полигенное дегенеративное заболевание глаз, вызывающее дегенерацию РПЭ, также связано с аберрантной аутофагией и липидным обменом в монослое РПЭ. Неспособность дисфункционального монослоя RPE обрабатывать POS и выполнять другие критические функции приводит к внеклеточным (суб-RPE) отложениям, называемым базальными линейными отложениями (BLinD), расположенными между RPE и мембраной Бруха – отличительной чертой патологий ВМД. Основные компоненты BLinD включают липопротеины, наиболее распространенным из которых является аполипопротеин E (APOE)4. Накопление тонких слоев BLinD может привести к появлению мягких друз, которые признаются клиническим симптомомВМД 5,6.
Несколько групп показали, что модели заболеваний in vitro, полученные из стволовых клеток, которые вызывают дисфункцию RPE, характеризуются накоплением липидов sub-RPE 7,8,9. Hallam et al. (2017) получили индуцированный плюрипотентный RPE, полученный из стволовых клеток (iRPE), у пациентов с высоким риском развития ВМД из-за полиморфизма гена CFH. iRPE показал накопление друз, как отмечено APOE, а RPE с высоким риском накопил большие отложения, чем iRPE, генерируемый у пациентов с низким риском10.
Чтобы создать модель in vitro , которая повторяет клеточные признаки ВМД, такие как липидные капли и отложение друз, линии iRPE, полученные из образцов крови пациентов, были созданы с использованием ранее опубликованного протокола11, ориентированного на развитие. iRPE подвергали комплемент-компетентной сыворотке человека (CC-HS), раствору, содержащему анафилатоксины, которые имитируют одну из возможных причин ВМД: повышенную передачу сигналов альтернативного комплемента8. Результирующее клеточное и субклеточное отложение липидных отложений измеряли с использованием широко используемых липидных и липопротеиновых маркеров, APOE, Nile Red и BODIPY. С помощью этих маркеров было показано, что активированная передача сигналов комплемента через CC-HS усугубляет накопление липидов в клетках iRPE8.
Для разработки модели моногенного дегенеративного заболевания сетчатки были разработаны линии iRPE от пациентов с болезнью Штаргардта, заболеванием, вызванным мутациями гена ABCA4 в RPE. Ранее было показано, что при нокауте ABCA4 внутри RPE12 накапливается липофусцин A2E, внутриклеточное отложение, которое, как известно, содержит высокие уровни фосфолипидов и светозависимых продуктов перекисного окисления липидов. Нокаутирующие линии ABCA4 были разработаны наряду с линиями пациентов, и обе были подвергнуты POS-подаче. Stargardt iRPE продемонстрировал патологию, вызванную фагоцитозом POS, демонстрируя повышенное накопление липидов, количественно определяемое окрашиванием BODIPY. РПЭ, полученный из ИПСК ABCA4 KO, был подвергнут обработке CC-HS; количественная оценка сигнала BODIPY также показала дефект обработки липидов в модели болезни Штаргардта9.
Учитывая распространенность этих заболеваний и потребность в эффективных терапевтических средствах, наряду с соответствующими моделями заболеваний, описанными выше, необходимо разработать надежные методы количественной оценки эффективности потенциальных методов лечения. Для объективной, автоматизированной и стандартизированной количественной оценки липидных отложений было создано программное обеспечение на основе машинного обучения LipidUNet, чтобы в сочетании с инструментами анализа масок можно было быстро и эффективно идентифицировать отложение липидов с использованием общих маркеров Nile Red, BODIPY и APOE. Сводная статистика, полученная с помощью этого аналитического конвейера, затем может быть проанализирована и отображена графически, что позволяет легко сравнивать условия лечения. Схема протокола показана на рисунке 1.
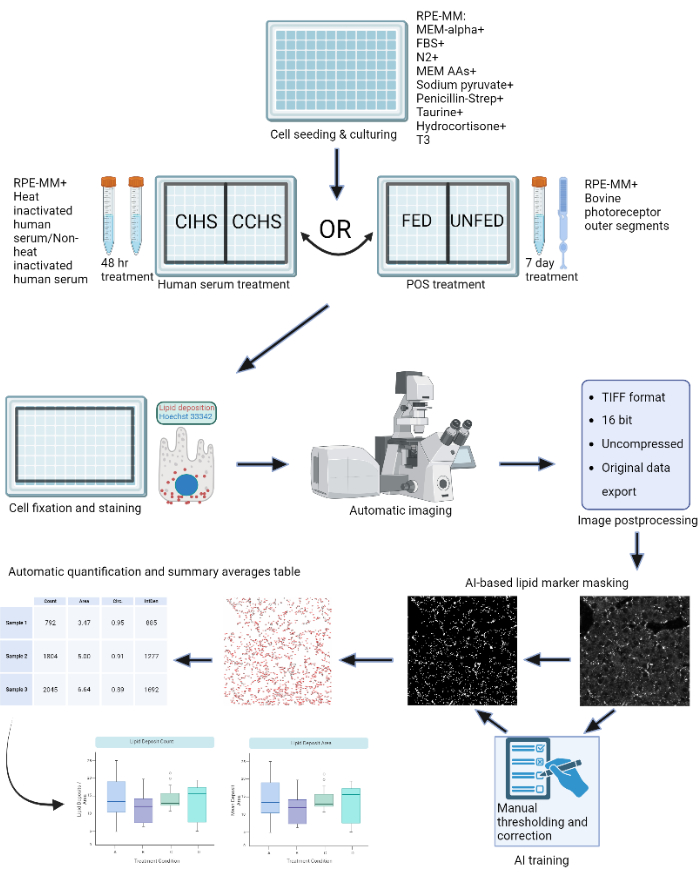
Рисунок 1: Схема протокола: клетки RPE выращивают на 96-луночном планшете и подвергают воздействию активной сыворотки человека или очищенных наружных сегментов крупного рогатого скота для моделирования различных типов дегенерации сетчатки in vitro. Клетки RPE фиксируются и окрашиваются для отложений липопротеинов с помощью Nile Red, BODIPY и APOE. Конфокальный микроскоп используется для получения Z-стеков флуоресцентно меченных липидных частиц, которые впоследствии обрабатываются в 2D-проекции максимальной интенсивности. Алгоритм машинного обучения был обучен распознавать и правильно сегментировать частицы липопротеинов. Генерируются сводные таблицы, содержащие количество частиц и различные метрики формы, которые можно использовать для последующего построения графиков и статистического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Этот протокол обеспечивает метод эффективной маркировки, изображения и количественного определения липидных отложений в моногенных и полигенных моделях заболеваний in vitro для дегенеративных заболеваний глаз. Программное обеспечение на основе искусственного интеллекта LipidUNet может быть применено к трем распространенным липидным маркерам, APOE, Nile Red и BODIPY, и обеспечивает быстрый автоматический метод анализа, который позволяет количественной оценке быть стандартной и объективной.
Основным ограничением LipidUNet является тот факт, что набор обучающих данных для ИИ был ограничен изображениями клеток с 40-кратным увеличением, культивируемых в 96-луночном планшете. В результате набора обучающих изображений LipidUNet в его нынешнем виде ограничен анализом изображений с 40-кратным увеличением. Программное обеспечение может быть использовано для анализа 40-кратных изображений клеток, культивируемых на других культуральных поверхностях, помимо 96-луночной пластины, но следует позаботиться о проверке сгенерированных выходных масок для проверки точного порогового значения программным обеспечением. Потребуется больше наборов изображений (с разным увеличением), чтобы расширить область применения образцов/изображений, которые он может анализировать.
Протокол состоит из нескольких важных этапов. На этапе липидного маркера пользователь должен подтвердить, что выбранное им маркировочное соединение (BODIPY, APOE, Nile Red) эффективно маркировало его образец. Зрелые клетки RPE часто сильно пигментированы, что может ухудшить флуоресцентный сигнал иммуноокрашивания антителами. Когда сигнал флуоресценции слабый или когда слишком много фонового окрашивания, LipidUNet не может точно различать липидные капли. По той же причине необходимо использовать правильно выбранные параметры сбора данных для этапа автоматической визуализации протокола. Если полученные изображения имеют низкое качество, LipidUNet будет изо всех сил пытаться правильно маскировать изображения, и, следовательно, количественная оценка будет неточной (рис. 6A-L). Наконец, постобработка изображений является важным шагом, поскольку LipidUNet предъявляет особые требования к программному обеспечению для работы.
По сравнению с рабочими процессами для анализа липидов, в которых используется ручная пороговая оценка, или методами, включающими автоматическое пороговое значение в программном обеспечении, таком как Fiji, LipidUNet предлагает непредвзятую и надежную сегментацию по изображениям с переменным отложением липидов, что отражается в небольшой частоте ошибок при идентификации липидных частиц (рис. 7). Программное обеспечение позволяет пользователю вводить дополнительные обучающие изображения, что позволяет анализировать наборы изображений, выходящие за рамки тех, которые используют объектив 40-кратного увеличения, или даже тех, которые используют другой липидный маркер, как указано в протоколе. В будущем программное обеспечение будет обучено анализировать 3D-изображения, чтобы можно было количественно оценить объем липидных отложений. Дегенеративные заболевания глаз, которые связаны с отложением липидов в качестве основного фактора патологии, широко распространены, и, по прогнозам, случаи будут увеличиваться по мере увеличения пожилого населения13. Точные модели заболеваний и эффективные инструменты анализа, как мы изложили в этом протоколе, позволят разработать новые терапевтические вмешательства.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Мы благодарим гистологическое ядро Национального института глаз (NEI) за использование конфокальной системы Zeiss. Эта работа была поддержана фондами NEI IRP (номер гранта ZIA EY000533-04).
Materials
| 0.22 µm Steriflip filter system | EMD Millipore | SCGP00525 | |
| 1x Dulbecco's Phosphate Buffered Saline | Gibco | 14190-144 | |
| 3,3',5-Triiodo-L-thyronine | Sigma | T5516 | |
| Albumin Bovine, Fraction V | MP Biomedical | 160069 | |
| Alexa Fluor 555 rabbit anti-goat IgG (H+L) | Invitrogen | A21431 | APOE secondary antibody |
| APOE primary antibody | Millipore Sigma | AB947 | |
| BODIPY 493/503 | Invitrogen | D3922 | Protect from light |
| Complement competent human serum | Millipore Sigma | S1-LITER | |
| CTS N2 Supplement | Life Technologies | A13707-01 | |
| Fetal Bovine Serum | Hyclone | SH30071.03 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Slide mounting media |
| Glass Cover Slips #1 1/2 22 mm x 22 mm | Electron Microscopy Sciences | 72204-01 | |
| Glass Microscope Slide 25 mm x 75 mm- 1.2 mm Thick | Electron Microscopy Sciences | 71870-01 | |
| Hydrocortisone | Sigma | H0396 | |
| MEM Alpha | Life Technologies | 12571-063 | |
| MEM non-essential Amino Acids | Life Technologies | 11140 | |
| Nile Red | Sigma | 72485-100MG | Protect from light |
| Paraformaldehyde 16% Solution, EM Grade | Electron Microscopy Sciences | 15710 | |
| Penicillin-Strep | Life Technologies | 15140-148 | |
| Phosphate Buffered Saline 10x | Gibco | 70011-044 | |
| Rod Outer Segments (OS) | InVision Bioresources | 98740 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium Pyruvate | Life Technologies | 11360-070 | |
| Sucrose | Sigma Aldrich | S1888 | |
| SYBR Green Master Mix | Bio-Rad | 1725274 | |
| Taurine | Sigma | T0625 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| Tween 20 Ultrapure | Affymetrix | 9005-64-5 | |
| Vitronectin | Life Technologies | A14701SA | |
| Y-27632 dihydrochloride | R&D Systems | 1254 |
References
- Kanow, M. A., et al. Biochemical adaptations of the retina and retinal pigment epithelium support a metabolic ecosystem in the vertebrate eye. eLife. 6, e28899 (2017).
- Adijanto, J., et al. The retinal pigment epithelium utilizes fatty acids for ketogenesis. The Journal of Biological Chemistry. 289 (30), 20570-20582 (2014).
- Farnoodian, M., et al. Cell-autonomous lipid-handling defects in Stargardt iPSC-derived retinal pigment epithelium cells. Stem Cell Reports. 17 (11), 2438-2450 (2022).
- Curcio, C. A. Soft drusen in age-related macular degeneration: Biology and targeting via the oil spill strategies. Investigative Ophthalmology & Visual Science. 59 (4), AMD160-AMD181 (2018).
- Cankova, Z., Huang, J. D., Kruth, H. S., Johnson, M. Passage of low-density lipoproteins through Bruch’s membrane and choroid. Experimental Eye Research. 93 (6), 947-955 (2011).
- Curcio, C. A., et al. Esterified and unesterified cholesterol in drusen and basal deposits of eyes with age-related maculopathy. Experimental Eye Research. 81 (6), 731-741 (2005).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360 (2021).
- Sharma, R., et al. Epithelial phenotype restoring drugs suppress macular degeneration phenotypes in an iPSC model. Nature Communications. 12 (1), 7293 (2021).
- Farnoodian, M., et al. Cell-autonomous lipid-handling defects in Stargardt iPSC-derived retinal pigment epithelium cells. Stem Cell Reports. 17 (11), 2438-2450 (2022).
- Hallam, D., et al. An induced pluripotent stem cell patient specific model of complement factor H (Y402H) polymorphism displays characteristic features of age-related macular degeneration and indicates a beneficial role for UV light exposure. Stem Cells (Dayton, Ohio). 35 (11), 2305-2320 (2017).
- Sharma, R., Bose, D., Montford, J., Ortolan, D., Bharti, K. Triphasic developmentally guided protocol to generate retinal pigment epithelium from induced pluripotent stem cells. STAR Protocols. 3 (3), 101582 (2022).
- Issa, P. C., Barnard, A. R., Herrmann, P., Washington, I., MacLaren, R. E. Rescue of the Stargardt phenotype in Abca4 knockout mice through inhibition of vitamin A dimerization. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8415-8420 (2015).
- GBD 2019 Blindness and Vision Impairment Collaborators. Blindness and Vision Impairment Collaborators. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the Right to Sight: an analysis for the Global Burden of Disease Study. Lancet Global Health. 9 (2), e144-e160 (2021).

