Ikke-invasiv overvåking av mikrovaskulær oksygenering og reaktiv hyperemi ved bruk av hybrid, nær-infrarød diffus optisk spektroskopi for kritisk behandling
Summary
Vi beskriver en protokoll for ikke-invasiv og kontinuerlig måling av absolutt mikrovaskulær blodstrømningsindeks og oksygenmetning i blodet ved hjelp av en multimodal enhet basert på nær-infrarød diffus optikk. Vi evaluerer deretter metabolismen av oksygenforbruk og reaktiv hyperemi ved hjelp av en vaskulær okklusjonstest.
Abstract
Påvisning av nivåer av svekkelse i mikrovaskulær oksygenforbruk og reaktiv hyperemi er viktig i kritisk omsorg. Det finnes imidlertid ingen praktiske virkemidler for en robust og kvantitativ evaluering. Denne artikkelen beskriver en protokoll for å evaluere disse svekkelsene ved hjelp av en hybrid nær-infrarød diffus optisk enhet. Enheten inneholder moduler for nær-infrarød tidsløst og diffus korrelasjonsspektroskopi og pulsoksimetri. Disse modulene tillater ikke-invasiv, kontinuerlig og sanntidsmåling av absolutt, mikrovaskulær blod / vev oksygenmetning (StO2) og blodstrømningsindeksen (BFI) sammen med perifer arteriell oksygenmetning (SpO2). Denne enheten bruker et integrert, datastyrt turniquetsystem for å utføre en standardisert protokoll med optisk datainnsamling fra brachioradialismuskelen. Den standardiserte vaskulære okklusjonstesten (VOT) tar seg av variasjonene i okklusjonsvarighet og trykk rapportert i litteraturen, mens automatiseringen minimerer forskjeller mellom operatører. Protokollen vi beskriver fokuserer på en okklusjonsperiode på 3 minutter, men detaljene beskrevet i denne artikkelen kan lett tilpasses andre varigheter og mansjetttrykk, så vel som andre muskler. Inkluderingen av en utvidet måling av gjenopprettingsperiode ved baseline og etter okklusjon gjør det mulig å kvantifisere baselineverdiene for alle parametrene og deoksygeneringshastigheten for blod/vev som tilsvarer metabolismen av oksygenforbruk. Når mansjetten er sluppet, karakteriserer vi vevets reoksygeneringshastighet, størrelse og varighet av den hyperemiske responsen i BFI og StO2. Disse sistnevnte parametrene tilsvarer kvantifiseringen av den reaktive hyperemien, som gir informasjon om endotelfunksjonen. Videre gir de ovennevnte målingene av den absolutte konsentrasjonen av oksygenert og deoksygenert hemoglobin, BFI, den avledede metabolske hastigheten av oksygenforbruk, StO2 og SpO2 et ennå ikke utforsket rikt datasett som kan utvise sykdommens alvorlighetsgrad, personlig terapi og ledelsesintervensjoner.
Introduction
Kritisk syke pasienter, spesielt de med sepsis og andre lignende tilstander, viser ofte nedsatt reaktiv hyperemi og mikrovaskulær oksygenering 1,2,3. Under de første bølgene av COVID-19-pandemi krevde et uforutsett antall pasienter intensivbehandling, der virusets innvirkning på endotelet ble tydelig, men uten en klar strategi for å vurdere og håndtere 4,5,6. Som et resultat har det vært en økende anerkjennelse av viktigheten av å oppdage endoteldysfunksjon, som indirekte kan evalueres ved reaktiv hyperemi, i kritisk omsorg,dvs. En praktisk, robust og allment tilgjengelig vurdering av oksygentilførsel og forbruk til vevet forventes å være av største betydning for å optimalisere gjenopplivingsstrategier og direkte adressere mikrosirkulasjonsproblemer. Studier har konsekvent vist at vedvarende mikrosirkulasjonsendringer og mangel på sammenheng mellom makrosirkulasjon og mikrosirkulasjon til en viss grad er prediktive for organsvikt og ugunstige utfall hos pasienter som er rammet av septisk sjokk eller hemorragisk sjokk, blant andre kritiske tilstander, selv når systemiske parametere anses å være normale 8,9,10. Det har blitt tydelig at det er utilstrekkelig å stole utelukkende på makrosirkulasjonsparametere, da mikrosirkulasjon spiller en kritisk rolle i oksygenering av vev og organfunksjon 11,12,13. Dette papiret beskriver en protokoll som bruker en ny multimodal enhet basert på nær-infrarød diffus optisk teknologi som er utviklet i et internasjonalt konsortium som fokuserer på ICU-pasienter. Prosjektet, VASCOVID (https://vascovid.eu), var motivert av COVID-19-pandemien for å evaluere mikrovaskulær helse i perifere muskler i intensivbehandling. Vi har designet en protokoll ved hjelp av den utviklede VASCOVID-enheten som tar sikte på å forbedre vår forståelse av disse parametrene og hvordan disse parametrene kan være nyttige for å håndtere kritisk syke pasienter med et mye bredere omfang enn COVID-19-pasienter.
Nær infrarød spektroskopi (NIRS) har blitt brukt til å vurdere mikrosirkulasjon ikke-invasivt i flere tiår i et bredt spekter av kliniske applikasjoner, inkludert ICU-pasientene 14,15,16,17. Det er viktig å merke seg at den enkleste anvendelsen av NIRS, dvs. kontinuerlig bølge NIRS (CW-NIRS), er implementert i mye brukte og klinisk godkjente enheter17,18, som brukes til å måle de absolutte konsentrasjonene av oksy- (HbO) og deoksyhemoglobin (HbR) for å beregne oksygenmetningen i blod / vev (StO2) av mikrovaskulaturen. Selv om disse enhetene har funnet nisjebruk i klinisk ledelse, for eksempel under hjertekirurgi, har de klare begrensninger på grunn av fysikken til fotonutbredelse i vev. Dette betyr at deres nøyaktighet, presisjon og repeterbarhet er tvilsom, derfor brukes de ofte som trendmonitorer19,20. Videre er resultatene deres sterkt påvirket av overfladiske vev som overliggende fett- og hudlag.
Tidsløst NIRS (TRS) benytter korte laserpulser i picosekundområdet ved flere bølgelengder for å vurdere deres forsinkelse og utvidelse etter traversering gjennom et vev21. Dette gjør det mulig for TRS å skille effektene av absorpsjon fra spredning for å oppnå robuste, nøyaktige og presise estimater, og også tillate det å beregne total hemoglobinkonsentrasjon (HbT). Siden TRS også løser banelengder, kan den brukes til å bedre skille overfladiske signaler fra de dype signalene av interesse18,21. Dette kommer på bekostning av kompleksitet, pris og bulkiness. Men de siste årene har TRS-systemer kommet ned i kompleksitet og kostnad, noe som resulterer i mer tilgjengelige og enklere å bruke enheter. Dette manuskriptet beskriver en enhet som bruker en kompakt OEM-kommersiell TRS-modul22,23.
Diffus korrelasjonsspektroskopi (DCS) er en annen nær-infrarød teknologi som benytter den tidsmessige statistikken til diffuse flekker for å kvantifisere bevegelsen av lysspredende partikler, som domineres av røde blodlegemer i vev 16,24. Dette er igjen kjent for å være en indikator på mikrovaskulær blodstrøm, som vi refererer til som blodstrømningsindeksen (BFI)25. Samtidig bruk av TRS og DCS i en hybrid optisk enhet gir innsikt i oksygenmetabolisme ved å benytte vanlige modeller for å utlede den lokale oksygenekstraksjonsfraksjonen og multiplisere med blodstrømmen 15,26,27.
For å vurdere mikrosirkulasjonen på intensivavdelingen brukes NIRS ofte med en vaskulær okklusjonstest (VOT), som er en iskemisk utfordring som utføres ved å blokkere blodtilførselen til den undersøkte perifere muskelen i en viss varighet (noen få minutter)28,29,30,31,32. Vanligvis utføres det ved å blåse opp en turniquet viklet rundt overarmen over det systoliske trykket33. Under VOT vurderer klinikerne responsen av mikrovaskulær oksygenering av blodet til endringer i blodstrømmen for å utlede oksygenmetabolisme i hvile og reaktiv hyperemi34. Forutsetningen er at under VOT, med mansjetten oppblåst godt over okklusjonstrykket i lemmene, er det ingen innstrømning eller utstrømning av blod. Derfor viser starten av VOT en nedadgående skråning av StO2, dvs. deoksygenering (DeO2), da oksygen forbrukes av vevet, noe som tillater et estimat av metabolismen av oksygenforbruk. Når VOT slutter og mansjetten tømmes, strømmer blodet inn for å kompensere for uttømmingen, noe som fører til en hyperemisk respons. Dette rushet genererer en skarp oppadgående skråning i StO2, dvs. en reoksygenering (ReO2). Den hyperemiske responsen, som er en økning utover den opprinnelige baseline med en langsom bedring tilbake til baseline, estimerer den reaktive hyperemien. Kombinasjonen av NIRS med en VOT har fått økende interesse for intensivbehandling på grunn av sin brukervennlighet og potensial for å forutsi uønskede utfall og til og med dødelighet i kritiske tilstander som sepsis 35,36,37.
Under COVID-19-pandemien har gruppene våre initiert et verdensomspennende konsortium og nylig fullført den såkalte HEMOCOVID-19-studien, som viser en sammenheng mellom perifere mikrosirkulasjonsendringer og alvorlighetsgraden av akutt lungesviktsyndrom hos COVID-19-pasienter6. Dette ble støttet av andre arbeider også 7,38. Alle disse studiene ble gjort med de ovennevnte CW-NIRS-systemene, og lider dermed av deres mangler. Videre var utførelsen av VOT ikke standardisert på tvers av ulike studier og påvirkes av ulike parametere som okklusjonsvarighet, tourniquettrykk og operatørbaserte variasjoner 29,39,40. En litteraturgjennomgang viser tydelig at for at VOT og NIRS skal få gjennomslag i klinikkene, er det viktig å måle blodstrøm, ha standardiserte protokoller og ha et robust NIRS-system11. Derfor har vi foreslått at ved å bruke en mer avansert form for NIRS (TRS), måle blodstrømmen og standardisere mansjettkontrollen under VOT, kan en bedre diskriminering av patologiske forhold fra friske oppnås. For det formål har vi utviklet denne hybriddiffuse optiske enheten som integrerer flere moduler som omfatter to nær-infrarøde diffuse optiske moduler av TRS og DCS, pulsoksymetri og en automatisert turniquet. Pulsoksymetrimodulen gir hjertefrekvens (HR), perfusjonsindeks og prosentandel av arteriell oksygenmetning (SpO2). En rask turniquet brukes i enheten, noe som er kritisk for å utføre VOT. Enheten leveres med en valgfri tilbehørsboks som lar oss skaffe ytterligere informasjon under bruk for utvidet og kontinuerlig kvalitetskontroll, for eksempel rutinemessig og praktisk måling av instrumentresponsfunksjonen (IRF) for TRS og måling på et vevslignende fantom for evaluering av langsgående stabilitet. Apparatet er vist som benyttet på intensivavdeling i figur 1.
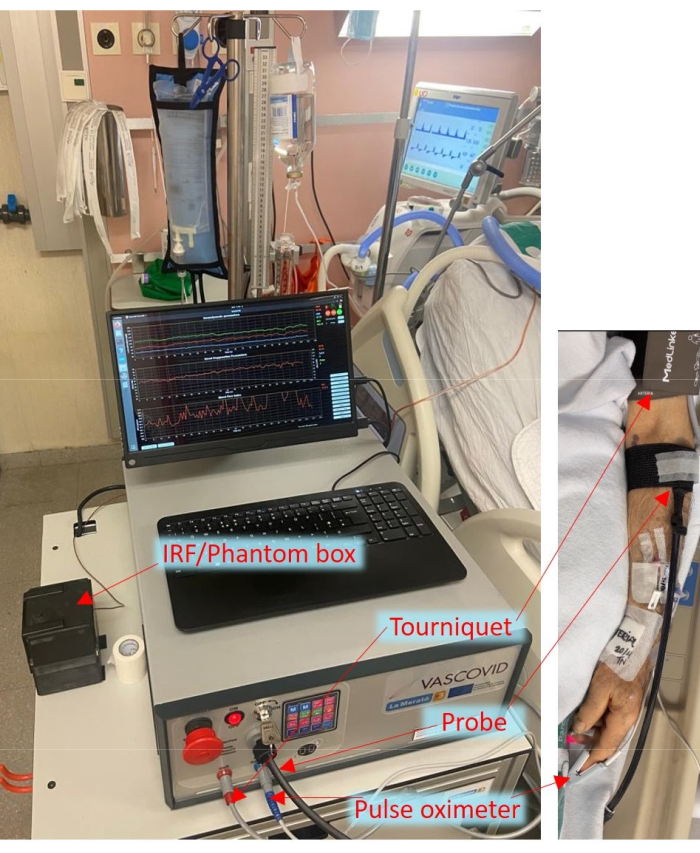
Figur 1 Sengearrangement av det bærbare apparatet på intensivavdelingen med sonder og mansjett festet til pasienten. Klikk her for å se en større versjon av denne figuren.
Den multimodale smarte sonden inneholder optiske kilde- og detektorfibre for både TRS og DCS med optiske filtre inne i enheten som forhindrer interferens mellom DCS og TRS. Kildedetektorseparasjonen som brukes i dette systemet er 25 mm. I tillegg har sonden en kapasitiv berøringssensor, som gir en verdifull sikkerhetsfunksjon for å forhindre laserfarer i henhold til lasersikkerhetsstandarden (IEC 60601-2-22: 2019) 41. Lasersikkerhetssystemet i enheten sikrer at laserutslippet bare skjer når sonden er i kontakt med vevet. Hvis det oppdages løsrivelse av sonden, slås laserne umiddelbart av, noe som sikrer sikkerheten til både pasienter og operatører. Videre er sonden integrert med et akselerometer, lastsensor og lyssensor for ytterligere funksjonalitet og datainnsamlingsformål.
Dette papiret beskriver den automatiserte protokollen der vi undersøker brachioradialis muskelen samtidig med en VOT ved hjelp av den utviklede enheten. Protokollens tidslinje er vist i figur 2. Protokollen er fullstendig automatisert, og ingen operatørinngrep er nødvendig under utførelsen. Ved å utnytte egenskapene til denne nye enheten, tar vi sikte på å få verdifull innsikt som lar legene forstå fysiopatologien til perifert oksygenforbruk bedre og også vurdere forholdet mellom oksygenforbruk og levering, og dermed hjelpe dem med å forbedre pasientomsorgen omfattende og effektivt.
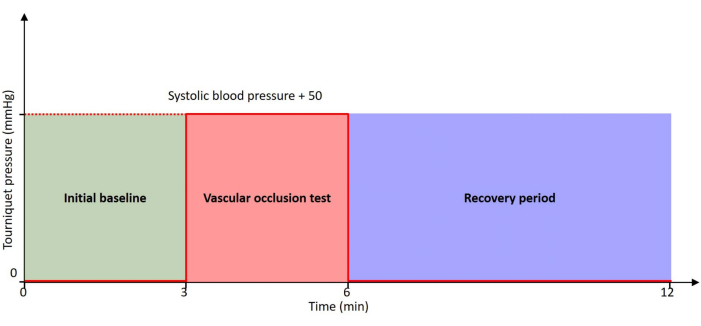
Figur 2: Protokollens tidslinje. Pasienten hviler gjennom hele tidslinjen med 0 mmHg trykk ved første baseline og restitusjonsperiode. VOT utføres med en turniquet oppblåst til et trykk på 50 mmHg høyere enn pasientens systoliske blodtrykk. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Vi har demonstrert en fullt automatisert, robust, ikke-invasiv enhet for kontinuerlig måling og overvåking av skjelettmuskulatur ved hjelp av hybrid diffus optikk for evaluering av mikrovaskulær oksygenering, blodperfusjon og reaktiv hyperemi. Ved å bruke denne protokollen med VASCOVID-enhet kan vi samtidig måle absolutte hemodynamiske parametere for HbO, HbR og HbT; oksygenmetning fra StO2 og SpO2; DeO2 og ReO2; og BFI. Den viste sanntids StO2 og BFI er hentet fra rådataene fra forrige sekund fra henholdsvis TRS- og DCS-modulene. Monteringsprosedyren er ikke tidkrevende, siden moderne prosessorer bruker standardmodeller av et halvuendelig, homogent medium. De oppnådde parametrene maler ikke det komplette bildet av endotelfunksjonen. Målt reaktiv hyperemi har imidlertid vist prognostisk verdi ved flere akutte tilstander der endotelutfallet spiller en stor rolle, som septisk sjokk eller covid-19. 6,28 Protokollen inneholder også en automatisert kvalitetskontroll som registrerer enhetsparametrene, som er nyttige for en forskningsprotokoll i tilfelle en uforklarlig anomali oppdages senere i pasientens data.
Kvantifiseringen av det overliggende fettlaget og armomkretsen er viktig ved måling av brachioradialismuskelen i denne protokollen, siden fotonene primært passerer gjennom det overliggende vevet når de injiseres og når de påvises. Det er velkjent innen diffus optikk at det er en assosiert partiell volumeffekt. Derfor bør den overfladiske informasjonen registreres og brukes når dataene analyseres for å ta hensyn til effekten av variasjoner i fettvev46,47. Dette forsterkes ytterligere i disse pasientpopulasjonene av interesse, siden det er vanlig hos ICU-pasienter å utvikle ødem der lemmer er hovne når vann er fanget på grunn av immobilisering og andre årsaker48. Hos slike pasienter kan variasjonen i omkrets under intensivopphold gi informasjon om alvorlighetsgraden av ødem. Banen til lyskilden som når detektorene, må passere gjennom alle overfladiske lag.
Mansjetten skal være komfortabelt viklet rundt armen, slik at den sitter tett. Det er imidlertid viktig å unngå overdreven tetthet som kan utøve overdreven press på armen utelukkende gjennom å pakke mansjetten49. Målet er å oppnå en sikker og komfortabel passform uten å forårsake unødvendig komprimering, noe som kan endre baseline hemodynamiske parametere. Hvis den komprimerer armen, vil datakvaliteten bli kompromittert for hele protokollen, og det utøvde trykket vil effektivt bli lagt til måltrykket til VOT. I tilfelle mansjetten er løst viklet til armen, vil det være nødvendig med mer luft for å nå måltrykket, og dermed vil det bli tatt mer tid. Dette kan gi tid til vev for å justere fysiologien ettersom oksygenforsyningen reduseres sakte, noe som bør unngås50.
Det er viktig å feste den smarte sonden på en måte som opprettholder riktig kontakt uten å utøve overdreven press på vevet. Dette muliggjør pålitelige målinger samtidig som man unngår risikoen for lokal iskemi. Lokal iskemi oppstår når blodstrømmen til området er begrenset, noe som fører til kompromittert sirkulasjon og potensielt ødelegger målingene51.
Den kapasitive berøringssensoren på sonden brukes av lasersikkerhetssystemet for å sikre at laseren bare skinner når sonden er festet til vevet. Hvis pasienten har høy hårtetthet på armen, kan følsomheten til berøringssensoren bli kompromittert. Påføring av et tynt gjennomsiktig dobbeltbånd på sensorsiden av sonden kan effektivt redusere problemet med berøringssensoren. Når sonden er festet til den hårete armen sammen med denne tapen, gir den et pålitelig og stabilt berøringssignal. Forhåndsdefinerte kutt av denne tapen er tilgjengelig for den smarte sonden med separasjon mellom lyskilder og detektorer. Separasjonen er viktig for å forhindre dannelse av en direkte lyskanal mellom kilde- og detektorvinduer, noe som kan påvirke kvaliteten på målingene. Bruken av gjennomsiktig dobbelttape fungerer som en praktisk løsning for å forbedre påliteligheten av berøringsregistrering under disse omstendighetene. Hvis berøringssensoren går tapt under protokollen, slår den av laserne og målingen går tapt. Sonden har også en lastsensor som i fremtiden kan brukes som et reservesikkerhetstiltak.
Hvis pasienten beveger armen eller et lite klinisk inngrep forstyrrer stabiliteten til oppnådde signaler i baselinefasen, noe som resulterer i skarpe topper, anbefales det å bruke utvidelsesfunksjonen. Denne funksjonen gjør det mulig å oppnå en stabil grunnlinje i tre minutter, noe som sikrer konsekvent og pålitelig signalmåling.
Det er viktig å vurdere at pasientens blodtrykk kan gjennomgå betydelige endringer etter at protokollen er initiert, noe som kan påvirke evnen til å nå måltrykket på 50 mmHg høyere enn det systoliske blodtrykket for VOT. Disse svingningene i blodtrykket kan påvirkes av ulike faktorer, for eksempel pasientens fysiologiske respons, medisineringseffekter eller andre kliniske tilstander52. Derfor bør måltrykket justeres ved å trykke på “+” eller “-” knappene om nødvendig for å sikre konsekvent administrering av VOT.
Den typiske utførelsen av VOT har begrensninger på grunn av operatørvariabilitet, noe som adresseres i denne protokollen ved å ha en automatisk VOT. Vi bruker strategien for å sette okklusjonstrykket på 50 mmHg over det systoliske blodtrykksnivået. Denne metoden stopper blodstrømmen og har blitt rapportert i tidligere studier for å utføre VOT53,54. Det individualiserte måltrykket for VOT i denne protokollen bidrar til å unngå vasokonstriksjon som kan skje ved å fikse et generelt måltrykk for VOT. Smerter forårsaket av unødvendig høyt trykk kan påvirke målingen og forårsake vasokonstriksjon, for eksempel hos en pasient med systolisk trykk på 120 mmHg og måltrykk på 200 mmHg eller 250 mmHg29. Vi bemerker at pasienter innlagt på intensivavdeling har økt risiko for trombose, først og fremst på grunn av faktorer som langvarig immobilitet og sedasjon55. Dette innebærer at for å unngå risiko, kan denne protokollen ikke brukes til pasienter som lider av trombose eller tromboflebitt.
Anvendelsen av denne protokollen kan være nyttig i ICU-populasjonen hvor nedsatt reaktiv hyperemi er et vanlig trekk og kan bidra til mikrovaskulære abnormiteter 3,56. Parametrene som er oppnådd i denne protokollen, uten operatørintervensjoner under målingen, har tidligere blitt brukt i litteraturen enkeltvis eller i en liten kombinasjon for sepsis, kreft, hjerneslag etc. for å skille patologiske tilstander 1,11,15,31. Derfor tror vi at kombinasjonen av disse relevante parametrene er gunstig for flere kliniske applikasjoner. Dataene som registreres av denne protokollen, kan bidra til å velge passende terapeutiske strategier for å forbedre vaskulær helse57. Den verdifulle innsikten i oksygenering av vev og blodstrømsdynamikk under okklusjon og reperfusjon tillater oss å vurdere tilstrekkelig blodtilførsel til vitale organer. Det kan hjelpe til med å identifisere vevshypoksi og veilede inngrep for å optimalisere organperfusjon58. Ved å bruke sanntidsinformasjon om mikrovaskulær oksygenering og reaktiv hyperemi, hjelper den som et ekstra verktøy for å veilede hemodynamisk styring, væskegjenoppliving og vasopressorterapi59,60. Dette sikrer at intervensjoner skreddersys til individuelle pasientbehov, og optimaliserer oksygenering av vev og perfusjon61,62. Videre, hos mekanisk ventilerte pasienter, kan utviklende endringer i mikrovaskulær oksygenering og blodstrøm i en spontan pusteprøve være av største betydning når man evaluerer kardiovaskulær toleranse for å møte og overvinne den økte metabolske byrden som er avledet av arbeidet med å puste uten hjelp2. En daglig kritisk og utfordrende beslutning for intensivpasientene om respiratorbehandling er avvenningsprosessen, som avsluttes når pasienten anses å være i stand til å puste selv, og endotrakealrøret fjernes. Den langsgående anvendelsen av denne protokollen kan brukes til å evaluere effektiviteten av intervensjoner, spore sykdomsprogresjon og veilede behandlingsstrategier.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denne forskningen ble finansiert av Fundació CELLEX Barcelona, Fundació Mir-Puig, Ajuntament de Barcelona, Agencia Estatal de Investigación (PHOTOMETABO, PID2019-106481RB-C31/10.13039/501100011033), “Severo Ochoa” -programmet for sentre for fremragende forskning og utvikling (CEX2019-000910-S), , Generalitat de Catalunya (CERCA, AGAUR-2017-SGR-1380, RIS3CAT-001-P-001682 CECH), FEDER EC, Fundacion Joan Ribas Araquistain, l’FCRI (Convocatòria Joan Oró 2023), Europakommisjonens horisont 2020 (Grants nr. 101016087 (VASCOVID), 101017113(TinyBrains), 871124 (LASERLAB-EUROPE V), 101062306 (Marie Skłodowska-Curie)), Fundació La Marató de TV3 (2017,2020) og LUX4MED/MEDLUX-spesialprogrammene.
Materials
| Alcohol swabs | No specific | N/A | For cleaning the probes and cuff after measurement |
| Black cloth | No specific | N/A | For blocking ambient light |
| Blood pressure monitor | OMRON | N/A | Hopital ICU equipment or off the shelf product |
| Body fat Calliper | Healifty | 3257040-6108-1618385551 | For measuring the fat layer |
| Examination gloves | No specific | N/A | To be used for interacting with patients |
| Kintex tape | No specific | N/A | For attaching the probe on arm |
| Koban wrap | No specific | N/A | For attaching the probe on arm |
| Measuring tape | YDM Industries | 25-SB-30-150V3-19-1 | For measuring the arm circumference |
| Scissors | No specific | N/A | for cutting tapes |
| VASCOVID precommercial prototype | VASCOVID consortium | N/A | Integrated at ICFO |
References
- Mesquida, J., Masip, J., Gili, G., Artigas, A., Baigorri, F. Thenar oxygen saturation measured by near infrared spectroscopy as a noninvasive predictor of low central venous oxygen saturation in septic patients. Intensive Care Medicine. 35, 1106-1109 (2009).
- Mesquida, J., et al. Thenar oxygen saturation (StO2) alterations during a spontaneous breathing trial predict extubation failure. Annals of Intensive Care. 10 (1), 1-7 (2020).
- Mikacenic, C., et al. Biomarkers of endothelial activation are associated with poor outcome in critical illness. PloS One. 10 (10), e0141251 (2015).
- Varga, Z., et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 395 (10234), 1417-1418 (2020).
- Castro, P., et al. Is the endothelium the missing link in the pathophysiology and treatment of COVID-19 complications. Cardiovascular Drugs and Therapy. 36 (3), 547-560 (2022).
- Mesquida, J., et al. Peripheral microcirculatory alterations are associated with the severity of acute respiratory distress syndrome in COVID-19 patients admitted to intermediate respiratory and intensive care units. Critical Care. 25, 1-10 (2021).
- Fernández, S., et al. Distinctive biomarker features in the endotheliopathy of COVID-19 and septic syndromes. Shock (Augusta, Ga). 57 (1), 95 (2022).
- Sakr, Y., Dubois, M. J., De Backer, D., Creteur, J., Vincent, J. L. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock). Critical Care Medicine. 32 (9), 1825-1831 (2004).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Tachon, G., et al. Microcirculatory alterations in traumatic hemorrhagic shock. Critical Care Medicine. 42 (6), 1433-1441 (2014).
- Duranteau, J., et al. The future of intensive care: the study of the microcirculation will help to guide our therapies. Critical Care. 27 (1), 1-13 (2023).
- Mason McClatchey, P., et al. Impaired tissue oxygenation in metabolic syndrome requires increased microvascular perfusion heterogeneity. Journal of Cardiovascular Translational Research. 10 (1), 69-81 (2017).
- Gurley, K., Shang, Y., Yu, G. Noninvasive optical quantification of absolute blood flow, blood oxygenation, and oxygen consumption rate in exercising skeletal muscle. Journal of Biomedical Optics. 17 (7), 075010 (2012).
- Lin, P. Y., et al. Non-invasive optical measurement of cerebral metabolism and hemodynamics in infants. Journal of Visualized Experiments. (73), e4379 (2013).
- Cortese, L., et al. The LUCA device: a multi-modal platform combining diffuse optics and ultrasound imaging for thyroid cancer screening. Biomedical Optics Express. 6 (6), 3392-3409 (2021).
- Durduran, T., Yodh, A. G. Diffuse correlation spectroscopy for non-invasive, micro-vascular cerebral blood flow measurement. Neuroimage. 85, 51-63 (2014).
- Hong, K. S., Yaqub, M. A. Application of functional near-infrared spectroscopy in the healthcare industry: A review. Journal of Innovative Optical Health Sciences. 12 (06), 1930012 (2019).
- Torricelli, A., et al. Time domain functional NIRS imaging for human brain mapping. Neuroimage. 85, 28-50 (2014).
- Tremblay, J. C., King, T. J. Near-infrared spectroscopy: can it measure endothelial function. Experimental Physiology. 101 (11), 1443-1444 (2016).
- Cortese, L., et al. Performance assessment of a commercial continuous-wave near-infrared spectroscopy tissue oximeter for suitability for use in an international, multi-center clinical trial. Sensors. 21 (21), 6957 (2021).
- Contini, D., et al. Multi-channel time-resolved system for functional near infrared spectroscopy. Optics Express. 14 (12), 5418-5432 (2006).
- Lacerenza, M., et al. Wearable and wireless time-domain near-infrared spectroscopy system for brain and muscle hemodynamic monitoring. Biomedical Optics Express. 11 (10), 5934-5949 (2020).
- Lacerenza, M., et al. Performance and reproducibility assessment across multiple time-domain near-infrared spectroscopy device replicas. Design and Quality for Biomedical Technologies XV – SPIE. 11951, 43-48 (2022).
- Durduran, T., Choe, R., Baker, W. B., Yodh, A. G. Diffuse optics for tissue monitoring and tomography. Reports on Progress in Physics. 73 (7), 076701 (2010).
- Boas, D. A., Campbell, L. E., Yodh, A. G. Scattering and imaging with diffusing temporal field correlations. Physical Review Letters. 75 (9), 1855 (1995).
- Giovannella, M., et al. BabyLux device: a diffuse optical system integrating diffuse correlation spectroscopy and time-resolved near-infrared spectroscopy for the neuromonitoring of the premature newborn brain. Neurophotonics. 6 (2), 025007-025007 (2019).
- Amendola, C., et al. A compact multi-distance DCS and time domain NIRS hybrid system for hemodynamic and metabolic measurements. Sensors. 21 (3), 870 (2021).
- Mesquida, J., Gruartmoner, G., Espinal, C. Skeletal muscle oxygen saturation (StO2) measured by near-infrared spectroscopy in the critically ill patients. BioMed Research International. (2013), (2013).
- Gerovasili, V., Dimopoulos, S., Tzanis, G., Anastasiou-Nana, M., Nanas, S. Utilizing the vascular occlusion technique with NIRS technology. International Journal of Industrial Ergonomics. 40 (2), 218-222 (2010).
- Siafaka, A., et al. Acute effects of smoking on skeletal muscle microcirculation monitored by near-infrared spectroscopy. Chest. 131 (5), 1479-1485 (2007).
- Donati, A., et al. Near-infrared spectroscopy for assessing tissue oxygenation and microvascular reactivity in critically ill patients: a prospective observational study. Critical Care. 20, 1-10 (2016).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvascular Research. 122, 117-124 (2019).
- Niezen, C. K., Massari, D., Vos, J. J., Scheeren, T. W. L. The use of a vascular occlusion test combined with near-infrared spectroscopy in perioperative care: a systematic review. Journal of Clinical Monitoring and Computing. 36 (4), 933-946 (2022).
- Donati, A., et al. Recombinant activated protein C treatment improves tissue perfusion and oxygenation in septic patients measured by near-infrared spectroscopy. Critical Care. 5 (5), 1-7 (2009).
- Neto, A. S., et al. Association between static and dynamic thenar near-infrared spectroscopy and mortality in patients with sepsis: a systematic review and meta-analysis. Journal of Trauma and Acute Care Surgery. 76 (1), 226-233 (2014).
- Shapiro, N. I., et al. The association of near-infrared spectroscopy-derived tissue oxygenation measurements with sepsis syndromes, organ dysfunction and mortality in emergency department patients with sepsis. Critical Care. 15 (5), 1-10 (2011).
- Orbegozo, D., et al. Peripheral muscle near-infrared spectroscopy variables are altered early in septic shock. Shock. 50 (1), 87-95 (2018).
- Lu, S., et al. Comparison of COVID-19 induced respiratory failure and typical ARDS: similarities and differences. Frontiers in Medicine. 9, 829771 (2022).
- Parežnik, R., Knezevic, R., Voga, G., Podbregar, M. Changes in muscle tissue oxygenation during stagnant ischemia in septic patients. Intensive Care Medicine. 32, 87-92 (2006).
- Nanas, S., et al. Inotropic agents improve the peripheral microcirculation of patients with end-stage chronic heart failure. Journal of Cardiac Failure. 14 (5), 400-406 (2008).
- International electrical equipment – IEC. Medical electrical equipment – Part 2-22: Particular requirements for basic safety and essential performance of surgical, cosmetic, therapeutic and diagnostic laser equipment. International electrical equipment – IEC. , (2019).
- Cortese, L., et al. Recipes for diffuse correlation spectroscopy instrument design using commonly utilized hardware based on targets for signal-to-noise ratio and precision. Biomedical Optics Express. 12 (6), 3265-3281 (2021).
- Zhou, C., et al. Diffuse optical correlation tomography of cerebral blood flow during cortical spreading depression in rat brain. Optics Express. 14 (3), 1125-1144 (2006).
- Selb, J., et al. Sensitivity of near-infrared spectroscopy and diffuse correlation spectroscopy to brain hemodynamics: simulations and experimental findings during hypercapnia. Neurophotonics. 1 (1), 015005-015005 (2014).
- Amendola, C., et al. Assessment of power spectral density of microvascular hemodynamics in skeletal muscles at very low and low-frequency via near-infrared diffuse optical spectroscopies. Biomedical Optics Express. 14 (11), 5994-6015 (2023).
- Craig, J. C., Broxterman, R. M., Wilcox, S. L., Chen, C., Barstow, T. J. Effect of adipose tissue thickness, muscle site, and sex on near-infrared spectroscopy derived total-[hemoglobin+ myoglobin]. Journal of Applied Physiology. 123 (6), 1571-1578 (2017).
- Nasseri, N., Kleiser, S., Ostojic, D., Karen, T., Wolf, M. Quantifying the effect of adipose tissue in muscle oximetry by near infrared spectroscopy. Biomedical Optics Express. 7 (11), 4605-4619 (2016).
- Ahmadinejad, M., Razban, F., Jahani, Y., Heravi, F. Limb edema in critically ill patients: Comparing intermittent compression and elevation. International Wound Journal. 19 (5), 1085-1091 (2022).
- Van Vo, T., Hammer, P. E., Hoimes, M. L., Nadgir, S., Fantini, S. Mathematical model for the hemodynamic response to venous occlusion measured with near-infrared spectroscopy in the human forearm. IEEE Transactions on Biomedical Engineering. 54 (4), 573-584 (2007).
- Junejo, R. T., Ray, C. J., Marshall, J. M. Cuff inflation time significantly affects blood flow recorded with venous occlusion plethysmography. European Journal of Applied Physiology. 119, 665-674 (2019).
- Baker, W. B., et al. Pressure modulation algorithm to separate cerebral hemodynamic signals from extracerebral artifacts. Neurophotonics. 3 (3), 035004-035004 (2015).
- Martirosov, A. L., et al. Improving transitions of care for critically ill adult patients on pulmonary arterial hypertension medications. American Journal of Health-System Pharmacy. 77 (12), 958-965 (2020).
- Bezemer, R., Lima, A., Klijn, E., Bakker, J., Ince, C. Assessment of tissue oxygen saturation during a vascular occlusion test using near-infrared spectroscopy: Role of the probe spacing and measurement site studied in healthy volunteers. Critical Care. (13), 1-2 (2009).
- Futier, E., et al. Use of near-infrared spectroscopy during a vascular occlusion test to assess the microcirculatory response during fluid challenge. Critical Care. (15), 1-10 (2011).
- Attia, J. R., et al. Deep vein thrombosis and its prevention in critically ill adults. Archives of Internal Medicine. 161 (10), 1268-1279 (2001).
- Reinhart, K., Bayer, O., Brunkhorst, F., Meisner, M. Markers of endothelial damage in organ dysfunction and sepsis. Critical Care Medicine. 30 (5), S302-S312 (2002).
- Georger, J. F., et al. Restoring arterial pressure with norepinephrine improves muscle tissue oxygenation assessed by near-infrared spectroscopy in severely hypotensive septic patients. Intensive Care Medicine. 36, 1882-1889 (2010).
- Lipcsey, M., Woinarski, N. C., Bellomo, R. Near infrared spectroscopy (NIRS) of the thenar eminence in anesthesia and intensive care. Annals of Intensive Care. 2 (1), 1-9 (2012).
- Kazune, S., Caica, A., Luksevics, E., Volceka, K., Grabovskis, A. Impact of increased mean arterial pressure on skin microcirculatory oxygenation in vasopressor-requiring septic patients: an interventional study. Annals of Intensive Care. 9 (1), 1-10 (2019).
- Lima, A., van Bommel, J., Jansen, T. C., Ince, C., Bakker, J. Low tissue oxygen saturation at the end of early goal-directed therapy is associated with worse outcome in critically ill patients. Critical Care. 13 (5), 1-7 (2009).
- Rogers, C. A., et al. Randomized trial of near-infrared spectroscopy for personalized optimization of cerebral tissue oxygenation during cardiac surgery. BJA: British Journal of Anaesthesia. 119 (3), 384-393 (2017).
- Jozwiak, M., Chambaz, M., Sentenac, P., Monnet, X., Teboul, J. L. Assessment of tissue oxygenation to personalize mean arterial pressure target in patients with septic shock. Microvascular Research. 132, 104068 (2020).

