ナノ・マイクロメートル小胞における非平衡代謝ネットワークの構築
Summary
膜タンパク質を再構成し、酵素やその他の水溶性成分をサブマイクロメートルおよびマイクロメートルサイズの脂質小胞にカプセル化するためのプロトコルを提示します。
Abstract
精製されたコンポーネントを使用して、内在性膜タンパク質、酵素、および蛍光ベースのセンサーを含む複雑なタンパク質ネットワークを小胞に組み込む方法を紹介します。この方法は、バイオリアクターの設計と構築、および複雑な非平衡代謝反応ネットワークの研究に関連しています。まず、以前に開発されたプロトコルに従って、(複数の)膜タンパク質を大きな単層小胞(LUV)に再溶解します。次に、精製された酵素、代謝物、および蛍光ベースのセンサー(蛍光タンパク質または色素)の混合物を凍結融解押出しでカプセル化し、遠心分離および/またはサイズ排除クロマトグラフィーによって非組み込み成分を除去します。代謝ネットワークのパフォーマンスは、ATP/ADP比、代謝物濃度、内部pH、または蛍光読み出しによるその他のパラメータを監視することにより、リアルタイムで測定されます。直径100-400 nmの膜タンパク質含有小胞は、既存の最適化された手順を使用して、巨大単層小胞(GUV)に変換できます。このアプローチにより、可溶性成分(酵素、代謝物、センサー)をマイクロメートルサイズの小胞に含めることができるため、バイオリアクターの容量を桁違いに拡大できます。GUVを含む代謝ネットワークは、光学顕微鏡による分析のためにマイクロ流体デバイスに閉じ込められます。
Introduction
ボトムアップ合成生物学の分野は、バイオテクノロジー3,4または生物医学目的5,6,7,8のための(最小限の)細胞1,2および代謝バイオリアクターの構築に焦点を当てています。合成細胞の構築は、研究者が天然環境のものを模倣した明確に定義された条件でタンパク質を研究(膜)することを可能にする独自のプラットフォームを提供し、タンパク質と反応ネットワークの創発的特性と隠された生化学的機能の発見を可能にします9。自律的に機能する合成細胞への中間ステップとして、代謝エネルギー保存、タンパク質および脂質合成、恒常性など、生細胞の本質的な特徴を捉えるモジュールが開発されています。このようなモジュールは、生命に対する理解を高めるだけでなく、医学8やバイオテクノロジー10の分野にも応用できる可能性がある。
膜貫通型タンパク質は、細胞内外で分子を輸送し、シグナルを送り、環境の質に応答し、多くの生合成の役割を果たすため、事実上あらゆる代謝ネットワークの中心にあります。したがって、合成細胞における代謝モジュールのエンジニアリングには、ほとんどの場合、内在性および/または末梢膜タンパク質を、特定の脂質と高い完全性(低透過性)で構成される膜二重層に再構成する必要があります。これらの膜タンパク質の取り扱いは困難であり、特定の知識と実験スキルが必要です。
リン脂質小胞内で膜タンパク質を再構成するためにいくつかの方法が開発されており、最も頻繁には、特定のタンパク質の機能11,12、調節13、速度論的特性14,15、脂質依存性15,16、および/または安定性17を研究する目的で開発されました。これらの方法は、脂質の存在下で界面活性剤可溶性タンパク質を水性媒体に迅速に希釈すること18、界面活性剤可溶化タンパク質を界面活性剤で不安定化した脂質小胞とインキュベートすることによる界面活性剤の除去、および界面活性剤のポリスチレンビーズへの吸収19、または透析またはサイズ排除クロマトグラフィー20による界面活性剤の除去を含む.有機溶媒は、例えば、油-水間相21の形成を介して脂質小胞を形成するために使用されてきたが、内在性膜タンパク質の大部分は、そのような溶媒に曝露されると不活性化される。
当研究室では、主に界面活性剤吸収法により膜タンパク質を再構成し、大単層小胞(LUV)19を形成する。この方法は、複数の膜タンパク質の共再構成および酵素、代謝物、およびプローブの小胞内腔へのカプセル化を可能にする22,23。膜タンパク質含有LUVは、電気形成24またはゲル支援膨潤25のいずれかを使用し、膜タンパク質26の完全性を維持するための特定の条件を用いて、水溶性成分のカプセル化の有無にかかわらず、巨大単層小胞(GUV)に変換することができる。
この論文は、L-アルギニンのL-オルニチンへの分解を通じてATPを再生する非平衡代謝ネットワークのLUVでの再構成のためのプロトコルを提示します27。ATPの形成は、リン脂質合成のための重要な構成要素であるグリセロール-3-リン酸(G3P)の産生と結合している22,28。代謝経路は、アルギニン/オルニチン(ArcD)とG3P/Piアンチポーター(GlpT)の2つの内在性膜タンパク質で構成されています。さらに、ATPのリサイクルには3つの可溶性酵素(ArcA、ArcB、ArcC)が必要であり、GlpKを使用してグリセロールをグリセロール3-リン酸に変換するために使用されます。L-アルギニンの分解からのATPを使用して、経路の概略図の概要については図1を参照してください。このプロトコールは、脂質やタンパク質の合成、または細胞の分裂など、さらに複雑な反応ネットワークを将来構築するための良い出発点となります。小胞の脂質組成は、多種多様な内在性膜タンパク質の活性をサポートし、小胞27,29,30の内外への多様な分子の輸送に最適化されている。
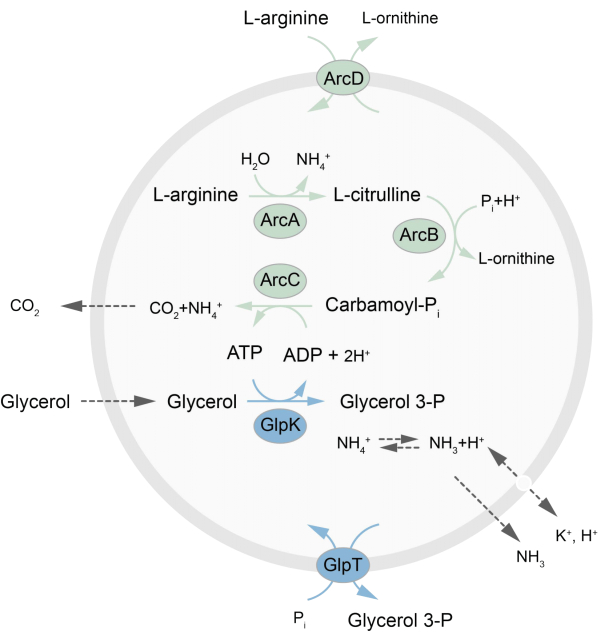
図1:ATP産生およびグリセロール3-リン酸の合成および排泄のための経路の概要。この図の拡大版を見るには、ここをクリックしてください。
要するに、精製された膜タンパク質(ドデシル-β-D-マルトシド、DDMに可溶化)を、Triton X-100で不安定化した予め形成された脂質小胞に添加することで、タンパク質を膜に挿入することができます。その後、活性剤分子は活性ポリスチレンビーズの添加によって(ゆっくりと)除去され、その結果、十分に密封されたプロテオリポソームが形成されます。次に、可溶性成分を小胞に添加し、凍結融解サイクルでカプセル化することで、膜融合の過程で分子を捕捉することができます。得られた小胞は非常に不均一であり、多くは多層です。次に、細孔径が400、200、または100nmのポリカーボネートフィルターを介して押し出され、より均一なサイズの小胞が得られます。細孔サイズが小さいほど、小胞はより均質で単層化されますが、その代償として内部容積が小さくなります。取り込まれていないタンパク質および低分子は、サイズ排除クロマトグラフィーによって外部溶液から除去されます。proteoLUVは、ゲルアシスト膨潤によってマイクロメートルサイズの小胞に変換することができ、これらのproteoGUVは、顕微鏡による特性評価と操作のためにマイクロ流体チップに収集およびトラップされます。 図2 は、完全なプロトコルの概略図の概要を示しています。
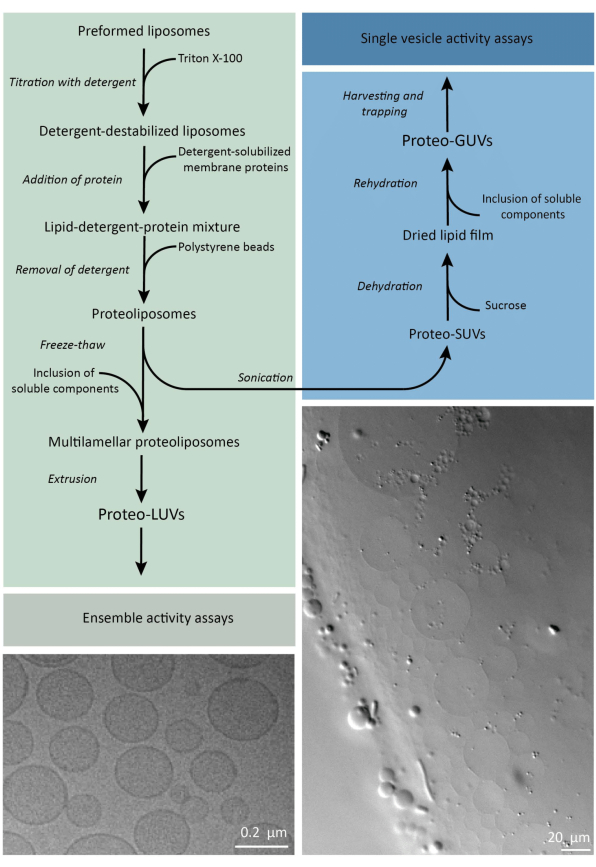
図2:サブマイクロメートル(LUV)およびマイクロメートルサイズ(GUV)の脂質小胞に膜タンパク質を再構成し、酵素および水溶性成分をカプセル化するためのプロトコルの概要。この図の拡大版を表示するには、ここをクリックしてください。
再構成およびカプセル化プロトコルは良好に機能し、タンパク質の機能は保持されますが、proteoLUVおよびproteoGUVのサイズは不均一です。マイクロ流体アプローチ31,32は、サイズがより均質なマイクロメートルサイズの小胞の形成を可能にするが、二重層内の残留溶媒がタンパク質を不活性化するため、膜タンパク質の機能的再構成は一般に不可能である。proteoLUVのサイズは100〜400 nmの範囲であり、低濃度の酵素では、カプセル化により代謝経路が不完全な小胞につながる可能性があります(確率的効果;図3を参照)。LUVは、ATPやG3Pなどのビルディングブロックの生成にここに示すように、特定の代謝モジュールを構築するのに理想的です。このようなプロテオLUVは、GUVにカプセル化され、宿主小胞のオルガネラ様コンパートメントとして機能する可能性があります。
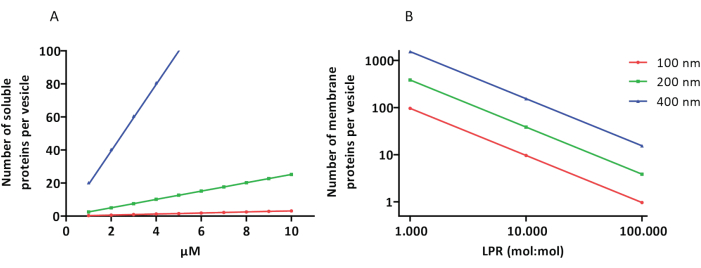
図3:直径100、200、または400nmの小胞あたりの分子数 (A) カプセル化されたタンパク質(酵素、プローブ)が1〜10 μMの範囲にある場合 (B) 再構成は、脂質(mol/mol)あたり1〜1,000、1〜10,000、および1〜100,000の膜タンパク質で行われます。分子は示された濃度でカプセル化され、これらのタンパク質と脂質の比率で膜に取り込まれると仮定します。一部の酵素では、それらが膜に結合し、小胞内の見かけの濃度を増加させる可能性があることがわかりました。略語:LPR = Lipid-Protein-Ratio この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
サブマイクロメートルサイズの脂質小胞を含む(膜)タンパク質(proteoLUV)の合成、およびproteoLUVの巨大単層小胞(proteoGUV)への変換のためのプロトコルを紹介します。このプロトコルは、他の膜タンパク質13,19,30,40の再構成、およびここに提示されているL-アルギニン分解およびグリセロール3-リン酸合成経路以外の代謝ネットワークのカプセル化に適用できるはずです。<s…
Divulgations
The authors have nothing to disclose.
Acknowledgements
著者らは、pBAD-PercevalHR遺伝子のクローニングを行ったAditya Iyer氏と、タンパク質の産生と精製を支援してくれたGea Schuurman-Wolters氏に感謝しています。この研究は、NWO重力プログラム「合成細胞の構築」(BaSyC)によって資金提供されました。
Materials
| Agarose | Sigma Aldrich | A9414-25g | |
| Amicon cut-off filter | Sigma Aldrich | Milipore centrifugal filter units Amicon Ultra | |
| BioBeads | BioRad | 152-3920 | |
| CHCl3 | Macron Fine Chemicals | MFCD00000826 | |
| D(+)-Glucose | Formedium | – | |
| D(+)-Sucrose | Formedium | – | |
| DDM | Glycon | D97002 -C | |
| Diethyl Ether | Biosolve | 52805 | |
| DMSO | Sigma-Aldrich | 276855-100ml | |
| DOPC | Avanti | 850375P-1g | |
| DOPE | Avanti | 850725P-1g | |
| DOPG | Avanti | 840475P-1g | |
| DTT | Formedium | DTT005 | |
| EtOH | J.T.Baker Avantor | MFCD00003568 | |
| Extruder | Avestin Inc | LF-1 | |
| Fluorimeter | Jasco | Spectrofluorometer FP-8300 | |
| Glycerol | BOOM | 51171608 | |
| Gravity flow column | Bio-Rad | 732-1010 | |
| Hamilton syringe 100 µL | Hamilton | 7656-01 | |
| Hamilton syringe 1000 µL | Hamilton | 81320 | |
| Handheld LCP dispenser | Art Robbins Instruments | 620-411-00 | |
| Handheld Sonicator | Hielscher Ultrasound Technology | UP50H | |
| HCl | BOOM | x76021889.1000 | |
| Imidazole | Roth | X998.4-250g | |
| K2HPO4 | Supelco | 1.05099.1000 | |
| KCl | BOOM | 76028270.1 | |
| KH2PO4 | Supelco | 1.04873.1000 | |
| Kimwipe | Kimtech Science | 7552 | |
| Large Falcon tube centrifuge | Eppendorf | Centrifuge 5810 R | |
| L-Arginine | Sigma-Aldrich | A5006-100G | |
| Light microscope | Leica | DM LS2 | |
| L-Ornithine | Roth | T204.1 | |
| LSM Laser Scanning Confocal Microscope | Zeiss | LSM 710 ConfoCor 3 | |
| MgCl2 | Sigma-Aldrich | M2670-1KG | |
| Microfluidic chip | Homemade | PDMS based | DOI: https://doi.org/10.1039/C8LC01275J |
| Na-ADP | Sigma-Aldrich | A2754-1G | |
| NaCl | Supelco | 1.06404.1000 | |
| Nanodrop Spectrometer | Isogen Life Science | ND-1000 spectrophotometer NanoDrop | |
| NaOH | Supelco | 1.06498.1000 | |
| Needles for GUVs | Henke-Ject | 14-14575 | 27 G x 3/4'' 0.4 x 20 mm |
| Needles for microfluidics | Henke-Ject | 14-15538 | 18 G x 1 1/2'' 1.2 x 40 mm |
| Ni2+ Sepharose | Cytiva | 17526802 | |
| Nigericin | Sigma-Aldrich | N7143-5MG | |
| Nutator | VWR | 83007-210 | |
| Osmolality meter | Gonotec Salmenkipp | Osmomat 3000 basic freezing point osmometer | |
| Plasmacleaner | Plasma Etch | PE-Avenger | |
| Polycarbonate filter | Cytiva Whatman | Nuclepor Track-Etch Membrane Product: 10417104 | 0.4 µm |
| Polycarbonate ultracentrifuge tube | Beckman Coulter | 355647 | |
| Pyranine | Acros Organics | H1529-1G | |
| Quartz cuvette (black) | Hellma Analytics | 108B-10-40 | |
| Sephadex G-75 resin | GE Healthcare | 17-0050-01 | |
| Sonicator | Sonics Sonics & Materials INC | Sonics vibra cell | |
| Syringe filter | Sarstedt | Filtropur S plus 0.2 | 0.2 µm |
| Syringe pump | Harvard Apparatus | A-42467 | |
| Tabletop centrifuge | Eppendorf | centrifuge 5418 | |
| Teflon spacer | Homemade | Teflon based | 45 x 26 x 1.5 or 45 x 26 x 3 or 20 x 20 x 3 mm |
| Tris | PanReac AppliChem | A1086.1000 | |
| Triton X-100 | Sigma Aldrich | T8787-100 ml | |
| Ultracentrifuge | Beckman Coulter | Optima Max-E | |
| UV lamp | Spectroline | ENB-280C/FE | |
| UV/VIS Spectrometer | Jasco | V730 spectrophotometer | |
| Valinomycin | Sigma-Aldrich | V0627-10MG | |
| Widefield fluorescence microscope | Zeiss | AxioObserver | |
| β-Casein | Sigma Aldrich | C5890-500g |
References
- Hirschi, S., Ward, T. R., Meier, W. P., Müller, D. J., Fotiadis, D. Synthetic biology: bottom-up assembly of molecular systems. Chem Rev. 122 (21), 16294-16328 (2022).
- Ivanov, I., et al. Bottom-up synthesis of artificial cells: recent highlights and future challenges. Annu Rev Chem Biomol. Eng. 12 (1), 287-308 (2021).
- Clomburg, J. M., Crumbley, A. M., Gonzalez, R. Industrial biomanufacturing: The future of chemical production. Science. 355 (6320), (2017).
- Shi, T., Han, P., You, C., Zhang, Y. -. H. P. J. An in vitro synthetic biology platform for emerging industrial biomanufacturing: Bottom-up pathway design. Synth Syst Biotechnol. 3 (3), 186-195 (2018).
- Wang, A., et al. Liver-target and glucose-responsive polymersomes toward mimicking endogenous insulin secretion with improved hepatic glucose utilization. Adv Funct Mater. 30 (13), 1910168 (2020).
- Kanter, G., et al. Cell-free production of scFv fusion proteins: an efficient approach for personalized lymphoma vaccines. Blood. 109 (8), 3393-3399 (2007).
- Zeltins, A. Construction and characterization of virus-like particles: a review. Mol Biotechnol. 53 (1), 92-107 (2013).
- Jain, K. K. Synthetic biology and personalized medicine. Med Princ Pract. 22 (3), 209-219 (2013).
- Schwille, P., Frohn, B. P. Hidden protein functions and what they may teach us. Trends Cell Biol. 32 (2), 102-109 (2022).
- Sachsenmeier, P. Industry 5.0-The relevance and implications of bionics and synthetic biology. Ingénierie. 2 (2), 225-229 (2016).
- Schmidt, D., Jiang, Q. -. X., MacKinnon, R. Phospholipids and the origin of cationic gating charges in voltage sensors. Nature. 444 (7120), 775-779 (2006).
- Godoy-Hernandez, A., et al. Rapid and highly stable membrane reconstitution by LAiR enables the study of physiological integral membrane protein functions. ACS Cent Sci. 9 (3), 494-507 (2023).
- Sikkema, H. R., et al. Gating by ionic strength and safety check by cyclic-di-AMP in the ABC transporter OpuA. Sci Adv. 6 (47), 7697 (2020).
- Foucaud, C., Poolman, B. Lactose transport system of Streptococcus thermophilus. Functional reconstitution of the protein and characterization of the kinetic mechanism of transport. J Biol Chem. 267 (31), 22087-22094 (1992).
- Yoneda, J. S., Sebinelli, H. G., Itri, R., Ciancaglini, P. Overview on solubilization and lipid reconstitution of Na,K-ATPase: enzyme kinetic and biophysical characterization. Biophys Rev. 12 (1), 49-64 (2020).
- Simidjiev, I., et al. Self-assembly of large, ordered lamellae from non-bilayer lipids and integral membrane proteins in vitro. Proc Natl Acad Sci. 97 (4), 1473-1476 (2000).
- Harris, N. J., Booth, P. J. Folding and stability of membrane transport proteins in vitro. Biochim Biophys Acta BBA – Biomembr. 1818 (4), 1055-1066 (2012).
- Jackson, M. L., Litman, B. J. Rhodopsin-egg phosphatidylcholine reconstitution by an octyl glucoside dilution procedure. Biochim Biophys Acta BBA – Biomembr. 812 (2), 369-376 (1985).
- Geertsma, E. R., Nik Mahmood, N. A. B., Schuurman-Wolters, G. K., Poolman, B. Membrane reconstitution of ABC transporters and assays of translocator function. Nat Protoc. 3 (2), 256-266 (2008).
- Rigaud, J. -. L., Pitard, B., Levy, D. Reconstitution of membrane proteins into liposomes: application to energy-transducing membrane proteins. Biochim Biophys Acta BBA – Bioenerg. 1231 (3), 223-246 (1995).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc Natl Acad Sci. 75 (9), 4194-4198 (1978).
- . Synthetic Organelles for Energy Conservation and Delivery of Building Blocks for Lipid Biosynthesis Available from: https://www.researchsquare.com/article/rs-3385355/v1 (2023)
- Lee, K. Y., et al. Photosynthetic artificial organelles sustain and control ATP-dependent reactions in a protocellular system. Nat Biotechnol. 36 (6), 530-535 (2018).
- Méléard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation. Methods in Enzymology. , 161-176 (2009).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. S. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J. Vis. Exp. (95), e52281 (2015).
- Doeven, M. K., et al. lateral mobility and function of membrane proteins incorporated into giant unilamellar vesicles. Biophys J. 88 (2), 1134-1142 (2005).
- Pols, T., et al. A synthetic metabolic network for physicochemical homeostasis. Nat Commun. 10 (1), 4239 (2019).
- Bailoni, E., Poolman, B. ATP recycling fuels sustainable glycerol 3-phosphate formation in synthetic cells fed by dynamic dialysis. ACS Synth Biol. 11 (7), 2348-2360 (2022).
- Van Der Heide, T. On the osmotic signal and osmosensing mechanism of an ABC transport system for glycine betaine. EMBO J. 20 (24), 7022-7032 (2001).
- Van’T Klooster, J. S., et al. Membrane lipid requirements of the lysine transporter Lyp1 from Saccharomyces cerevisiae. J Mol Biol. 432 (14), 4023-4031 (2020).
- Lou, G., Anderluzzi, G., Woods, S., Roberts, C. W., Perrie, Y. A novel microfluidic-based approach to formulate size-tuneable large unilamellar cationic liposomes: Formulation, cellular uptake and biodistribution investigations. Eur J Pharm Biopharm. 143, 51-60 (2019).
- Weiss, M., et al. Sequential bottom-up assembly of mechanically stabilized synthetic cells by microfluidics. Nat Mater. 17 (1), 89-96 (2018).
- Pols, T., Singh, S., Deelman-Driessen, C., Gaastra, B. F., Poolman, B. Enzymology of the pathway for ATP production by arginine breakdown. FEBS J. 288 (1), 293-309 (2021).
- Yandrapalli, N., Robinson, T. Ultra-high capacity microfluidic trapping of giant vesicles for high-throughput membrane studies. Lab Chip. 19 (4), 626-633 (2019).
- Elias, M., et al. Microfluidic characterization of biomimetic membrane mechanics with an on-chip micropipette. Micro Nano Eng. 8, 100064 (2020).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 044105 (2013).
- Cooper, A., Girish, V., Subramaniam, A. B. Osmotic Pressure Enables High-Yield Assembly of Giant Vesicles in Solutions of Physiological Ionic Strengths. Langmuir. 39 (15), 5579-5590 (2023).
- Tantama, M., Martínez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4 (1), 2550 (2013).
- Setyawati, I., et al. In vitro reconstitution of dynamically interacting integral membrane subunits of energy-coupling factor transporters. eLife. 9, e64389 (2020).
- Oropeza-Guzman, E., Ríos-Ramírez, M., Ruiz-Suárez, J. C. Leveraging the coffee ring effect for a defect-free electroformation of giant unilamellar vesicles. Langmuir. 35 (50), 16528-16535 (2019).
- Estes, D. J., Mayer, M. Electroformation of giant liposomes from spin-coated films of lipids. Colloids Surf B Biointerfaces. 42 (2), 115-123 (2005).

