위노그라드스키 칼럼 생성: 퇴적물 검체에서 미생물 종을 풍부하게하는 방법
English
Diviser
Vue d'ensemble
출처: 엘리자베스 수터1,크리스토퍼 코르보1,조나단 블레이즈1
1 생물과학부, 바그너 칼리지, 1 캠퍼스 로드, 스태튼 아일랜드 뉴욕, 10301
위노그라드스키 기둥은 퇴적물 미생물 공동체, 특히 유황 사이클링에 관련된 미생물 커뮤니티를 풍요롭게 하는 데 사용되는 소형동 밀폐형 생태계입니다. 이 칼럼은 1880년대에 세르게이 위노그라드스키에 의해 처음 사용되었으며 이후 광합성기, 황 산화제, 황산염 감속기, 메탄노겐, 철 산화제, 질소 사이클러 등과 같은 생화학에 관여하는 다양한 미생물의 연구에 적용되었습니다.
지구상의 미생물의 대부분은 테스트 튜브 또는 페트리 접시 (3)에서 분리 될 수 없다는 것을 의미하는, culturable것으로 간주됩니다. 이것은 많은 요인 에 기인, 미생물 특정 신진 대사 제품에 대 한 다른 사람에 의존 하는 것을 포함 하 여. 위노그라드스키 기둥의 조건은 다른 유기체와의 상호 작용을 포함하여 미생물의 자연 서식지를 밀접하게 모방하고 실험실에서 재배할 수 있게 합니다. 이를 위해, 이 기술은 과학자가 이 유기체를 연구하고 고립에서 그(것)들을 성장하지 않고 지구의 생지구화학적 주기에 어떻게 중요한지 이해하는 것을 허용합니다.
지구의 환경은 토양, 해수, 구름 및 심해 퇴적물과 같은 모든 유형의 서식지에서번성하는 미생물로 가득합니다. 모든 서식지에서 미생물은 서로 에 의존합니다. 미생물이 성장함에 따라 설탕과 같은 탄소가 풍부한 연료뿐만 아니라 영양소, 비타민 및 산소와 같은 호흡기를 포함하여 특정 기판을소비합니다. 이 중요한 자원이 다 소모될 때, 다른 신진 대사 필요를 가진 다른 미생물은 그 때 피고 번창할 수 있습니다. 예를 들어, 위노그라드스키 컬럼에서 미생물은 먼저 첨가된 유기 물질을 소비하면서 컬럼의 하단 층에서 산소를 고갈시다. 산소가 소진되면 혐기성 유기체가 다른 유기 물질을 인수하고 소비할 수 있습니다. 시간이 지남에 따라 다른 미생물 공동체의 이러한 연속적인 발달은 계승 (4)이라고합니다. 미생물 승계는 위노그라드스키 컬럼에서 중요하며, 여기서 미생물 활동은 퇴적물의 화학을 변화시키고, 이는 다른 미생물의 활동에 영향을 미칩니다. 토양과 퇴적물의 많은 미생물은 또한 기판의 농도 (5)에 근거를 둔 서식지의 두 개의 다른 모형 사이 과도기 구역인 그라데이션을따라 살고 있습니다. 그라데이션의 올바른 지점에서 미생물은 최적의 양의 상이한 기판을 받을 수 있습니다. 위노그라드스키 컬럼이 발전함에 따라, 특히 산소와 황화물에서 이러한 자연 그라데이션을 모방하기 시작합니다(도 1).
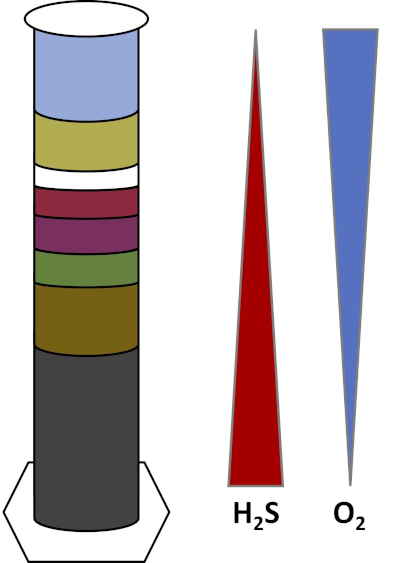
그림 1: 위노그라드스키 컬럼에서 발생하는 산소(O2)및 황화물(H2S) 그라데이션의 표현이다.
위노그라드스키 기둥에서 연못이나 습지의 진흙과 물은 투명한 기둥에 혼합되어 일반적으로 빛으로 배양할 수 있습니다. 추가 기판은 일반적으로 셀룰로오스 및 황의 형태로 탄소의 지역 사회 소스를 제공하기 위해 열에 추가됩니다. Photoynthesizer는 일반적으로 퇴적물의 상단 층에서 성장하기 시작합니다. 이러한 광합성 미생물은 주로 산소를 생성하고 녹색 또는 적갈색 층으로 나타나는 시아노박테리아로구성됩니다(도 2, 표 1). 광합성은 산소를 생성하는 동안, 산소는 물에 매우 용해되지 않으며이 층 아래에 감소 (도 1). 이것은 산소의 그라데이션을 만듭니다, 하단 층에 있는 산소의 높은 농도에서 구역 수색. 산소화된 층은 호기성 층이라고 하며 산소가 없는 층은 혐기성 층이라고 합니다.
혐기성 층에서, 많은 다른 미생물 공동체는 사용 가능한 기판의 종류 및 양, 초기 미생물의 근원 및 퇴적물의 다공성에 따라 증식할 수 있다. 기둥의 하단에, 혐기성 유기 물질을 분해 유기체는 번창 할 수 있습니다. 미생물 발효는 셀룰로오스의 분해에서 유기산을 생성합니다. 이러한 유기산은 황산염을 사용하여 그 유기물을 산화하고 부산물로 황화를 생산하는 황산 감속기에서사용할 수 있습니다. 황산염 감속기의 활성은 퇴적물이 검은 색으로 변하는 경우, 철과 황화물이 검은 철 황화 광물을 형성하기 위해 반응하기 때문에 표시됩니다(도 2, 표 1). 황화물은 또한 위쪽으로 확산되어 황화물 농도가 컬럼 의 맨 아래에 높고 컬럼 의 상단에 낮은 또 다른 그라데이션을 만듭니다 (도 1).
기둥 의 중간 근처, 황 산화제는 아래에서 산소의 공급을 활용하 고 아래에서 황화물. 적당한 양의 빛으로, 광합성 황 산화제는 이 층에서 발전할 수 있습니다. 이 유기체는 녹색과 보라색 유황 박테리아로알려져 있으며 종종 녹색, 보라색 또는 보라색 빨간색 필라멘트와 얼룩으로 나타납니다 (도 2, 표 1). 녹색 황 박테리아는 황화물에 대 한 높은 허용 오차를 가지고 일반적으로 보라색 황 박테리아 바로 아래 층에서 개발. 보라색 유황 박테리아 위에, 보라색 비황 박테리아는 또한 발전할 수 있습니다. 이 유기체는 황화물 대신 전자 기증자로 유기 산을 사용하여 광합성을 하고 종종 빨간색, 보라색, 주황색 또는 갈색 층으로 나타납니다. 비광합성 유황 산화제는 보라색 비황 박테리아 위에 발전할 수 있고, 이들은 일반적으로 백색 필라멘트로 나타납니다 (도 2, 표 1). 또한 위노그라드스키 열에서도 거품이 형성될 수 있습니다. 에어로빅 층의 거품은 시아노박테리아에 의한 산소 생산을 나타낸다. 혐기성 층의 거품은 유기물을 혐기성분해하고 부산물로 메탄을 형성하는 메탄오겐,유기체의 활성으로 인해 발생할 수 있습니다.
| 열의 위치 | 기능 그룹 | 유기체 예 | 시각적 표시기 |
| 맨 위로 | 포토진더스 | 시아노박테리아 | 녹색 또는 붉은 갈색 층. 때로는 산소의 거품. |
| 비광합성 유황 산화제 | 베기아토아, 티오바실루스 | 흰색 레이어. | |
| 보라색 비황 박테리아 | 로도마이크로비움, 로도스피리움, 로도프스포드모나스 | 빨간색, 보라색, 주황색 또는 갈색 레이어. | |
| 보라색 유황 박테리아 | 크로마티움 | 보라색 또는 보라색 빨간색 레이어. | |
| 녹색 유황 박테리아 | 클로로비움 | 녹색 레이어입니다. | |
| 황산염 감소 박테리아 | 데술포비비오, 데술포토마쿨룸, 데술포박터, 데술로모나스 | 검은 색 레이어. | |
| 밑바닥 | 메탄노겐 | 메탄노코커스, 메탄노사키나 | 때로는 메탄의 거품. |
표 1: 고전적인 위노그라드 스키 열에 나타날 수 있습니다 박테리아의 주요 그룹, 위에서 아래로. 각 그룹에서 유기체의 예가 주어지며, 유기체의 각 층의 시각적 지표가 나열됩니다. 페리 외 (2002) 및 로간 외 (2005)를 기반으로합니다.
Procédure
Résultats
In this experiment, water and sediment were collected from a freshwater habitat. Two Winogradsky columns were constructed and allowed to develop: a classical Winogradsky column incubated in the light at room temperature (Fig. 2A) and a Winogradsky column incubated in the dark at room temperature (Fig. 2B).

Figure 2B: A photo of classical Winogradsky column (left), incubated at room temperature in light for 68 days and a Winogradsky column incubated at room temperature in the dark for 68 days (right).
After allowing the columns to develop for 7-9 weeks, the layers in the classical column can be compared to the column incubated in the dark (Fig. 2B). In the classical Winogradsky column, a green cyanobacterial layer can be observed near the top of the tube. Near the center of the tube, a red-purple layer can be observed, indicative of purple nonsulfur bacteria. Under this layer, a purple-red layer is observed, indicative of purple sulfur bacteria. Directly under this layer, black sediment can be observed in the anaerobic region of the column, indicative of sulfate reducing bacteria.
The column grown in the dark (Fig. 2B) developed differently than the classical Winogradsky column. Like the classical column, the dark column yielded black sediment near the bottom of the column, indicative of sulfate reducing bacteria. The dark column did not yield the green cyanobacterial layer, nor the red, purple, or green layers indicative of purple nonsulfur, purple sulfur, and green sulfur bacteria, respectively. These groups are dependent on light for growth, and therefore unable to grow in the dark.
The precise results of each Winogradsky column will vary widely with their incubation conditions and their source habitats.
Microbial communities originating from freshwater habitats will not be accustomed to high salt concentrations and the addition of salt may slow down or inhibit growth. Conversely, there may be sufficient halophilic bacteria in brackish and saltwater habitats so that the addition of salts makes no difference or even enhances the growth of particular layers when compared to a column without added salts.
Sandy sediments are more porous than muddy sediments. If enough sulfide is produced in such porous sediments, sulfides can diffuse all the way to the top of the column and inhibit growth of aerobic organisms. In this case, the column may only contain layers indicative of anaerobes and may not contain any aerobes, such as the cyanobacteria.
Freshwater generally contains less sulfate than saltwater. Sulfate is important for the growth of sulfate-reducing bacteria. Sulfate reducers create sulfide as a byproduct and are indicated by the development of a black layer in the bottom of the column. If sulfate is not supplemented to freshwater communities, sulfate reducers may not produce enough sulfide. The creation of the sulfide byproduct is important for the growth of green and purple sulfur bacteria and the nonphotosynthetic sulfur oxidizers. In these cases, sulfur oxidizers can still grow using the egg yolk as a source of sulfur, even if the sulfate reducers (black layer) never develop.
Different wavelengths of light should select for organisms with different absorption pigments. A column kept in the dark will only allow for nonphotosynthetic organisms to grow, including sulfate reducers, iron oxidizers, and methanogens. Photosynthesizers have pigments that absorb light at different wavelengths within the visible range (~400-700nm). By covering a column with, for example, blue cellophane, blue light (~450-490nm) is blocked from entering the column. All of the photosynthesizers in the column have pigments which require the blue wavelengths (6) and their growth should be inhibited. On the other hand, red cellophane will block light of ~635-700nm. These wavelengths are important for the pigments used by cyanobacteria (6), while purple sulfur, green sulfur, and purple nonsulfur bacteria may still be able to grow.
Different microbial communities may have vastly different adaptive abilities to cope with changes in temperatures. High temperatures can enhance rates of microbial activity when sufficient thermophiles are present. On the other hand, in the absence of thermophiles, high temperatures may decrease overall microbial activity. Similarly, low temperatures may decrease overall microbial activity unless the microbial community contains sufficient psychrophiles.
Applications and Summary
The Winogradsky column is an example of an interdependent microbial ecosystem. After mixing mud, water, and additional carbon and sulfur substrates in a vertical column, the stratified ecosystem should stabilize into separate, stable zones over several weeks. These zones are occupied by different microorganisms which flourish at a particular spot along the gradient between the sulfide-rich sediment in the bottom and the oxygen-rich sediment at the top. By manipulating the conditions and substrates within the Winogradsky column, the presence and activity of different microorganisms such as halophiles, thermophiles, psychrophiles, sulfur oxidizers, sulfur reducers, iron oxidizers, and photosynthesizers can be observed.
References
- Zavarzin G. (2006). Winogradsky and modern microbiology. Microbiology 75(6): 501-511. doi: 10.1134/s0026261706050018
- Esteban DJ, Hysa B, and Bartow-McKenney C (2015). Temporal and Spatial Distribution of the Microbial Community of Winogradsky Columns. PLoS ONE 10(8): e0134588. doi:10.1371/journal.pone.0134588
- Lloyd KG, Steen AD, Ladau J, Yin J, and Crosby L. (2018). Phylogenetically novel uncultured microbial cells dominate Earth microbiomes. mSystems 3(5): e00055-18. doi:10.1128/mSystems.00055-18
- Anderson DC, and Hairston RV (1999). The Winogradsky Column & Biofilms: Models for Teaching Nutrient Cycling & Succession in an Ecosystem. The American Biology Teacher, 61(6): 453-459. doi: 10.2307/4450728
- Dang H, Klotz MG, Lovell CR and Sievert SM (2019) Editorial: The Responses of Marine Microorganisms, Communities and Ecofunctions to Environmental Gradients. Frontiers in Microbiology 10(115). doi: 10.3389/fmicb.2019.00115
- Stomp M, Huisman J, Stal LJ, and Matthijs HCP. (2007) Colorful niches of phototrophic microorganisms shaped by vibrations of the water molecule. ISME Journal. 1(4): 271-282. doi:10.1038/ismej.2007.59
- Perry JJ, Staley JT, and Lory S. (2002) Microbial Life, First Edition, published by Sinauer Associates
- Rogan B, Lemke M, Levandowsky M, and Gorrel T. (2005) Exploring the Sulfur Nutrient Cycle Using the Winogradsky Column. The American Biology Teacher, 67(6): 348-356. doi: 10.2307/4451860
Transcription
Most of the Earth’s microorganisms cannot be cultured in a lab, often because they rely on other microbes within their native communities. A Winogradsky column, named for its inventor Sergei Winogradsky, is a miniature, enclosed ecosystem which enriches the microbial communities within a sediment sample, enabling scientists to study many of the microbes that play a vital role in Earth’s biogeochemical processes, without needing to isolate and culture them individually.
Typically, mud and water from an ecosystem, such as a pond or a marsh, are mixed. As an optional experiment, salt can be added to this mixture to enrich various halophile species. Next, a small portion of the mixture is supplemented with carbon, usually in the form of cellulose from newspaper, and sulfur, usually from an egg yolk. For another optional experiment, a nail can be added to this mixture to enrich certain Gallionella species. This new mixture is then added to a transparent column, so that the column is one quarter full. Finally, the rest of the mud mixture and more water is added to the column until it is most of the way full.
Succession, which refers to the consecutive development of different microbial communities over time, can be observed in real time with a Winogradsky column. As microbes grow within the column, they consume specific substrates and change the chemistry of their environment. When their substrates are depleted, the original microbes die off and microbes with different metabolic needs can flourish in the altered environment. Over time, visibly distinct layers begin to form, each containing parts of a bacterial community with different microenvironmental needs.
For example, photosynthetic microbes, largely composed of cyanobacteria, form green or red-brown layers near the top of the column. Since photosynthesis produces oxygen, often seen as bubbles in the top portion of the column, a gradient is formed with the highest oxygen concentrations near the top, and the lowest towards the bottom. Depending upon the available substrates, different microbial communities can grow in the anaerobic bottom layer. Bubbles in this layer can indicate the presence of methanogens, which create methane gas via fermentation. Here, the microbial fermentation of cellulose results in organic acids. Sulfate reducers oxidize those acids to produce sulfide, and their activity is indicated by black sediment. Sulfide diffuses upward in the column, creating yet another gradient where sulfide concentrations are highest towards the bottom of the column, and lowest near the top. Towards the middle of the column, sulfur oxidizers utilize the oxygen from above and sulfide from below. With adequate light, photosynthetic sulfur oxidizers, such as green and purple sulfur bacteria, develop. Green sulfur bacteria tolerate higher sulfide concentrations. Thus, they grow directly below the purple sulfur bacteria. Directly above this layer, purple non-sulfur bacteria form a red-orange layer. Nonphotosynthetic sulfur oxidizers are indicated by the presence of white filaments.
Conditions such as light and temperature can also be varied to enrich other communities. In this video, you will learn how to construct a Winogradsky column, and vary the growing conditions and substrates to enrich specific microbial communities.
First, locate an appropriate aquatic ecosystem, such as a pond or marsh. The sediment samples should come from the area near the water’s edge, and be completely saturated with water. Then, use a shovel and a bucket to collect one to two liters of the saturated mud. Next, obtain approximately three liters of fresh water from the same source and return to the lab with the field samples.
In the lab, put on the appropriate personal protective equipment, including a lab coat and gloves. Now, transfer approximately 750 milliliters of mud to a mixing bowl. Then, sift through the mud to remove large rocks, twigs, or leaves and use a spoon to break apart any clumps. Next, add some of the fresh water to the mixing bowl, and stir with a large spoon. Add water until the consistency of the water-mud mixture is similar to a milkshake. Continue to make sure there are no clumps.
As an optional experiment, select for halophilic bacteria by adding 25 to 50 milligrams of salt to the mud mixture.
Then, transfer approximately 1/3 of the water-mud mixture to a second mixing bowl. Add one egg yolk and a handful of shredded newspaper to the bowl. Next, add this mixture to the column, until it is about 1/4 full. Next, add the water-mud mixture without the egg and newspaper to the column, until it is approximately 3/4 full. Then, add more water to the column, leaving a 1/2 inch space on top. Cover the column with plastic wrap and secure it with a rubber band.
Incubate the column in the light near a window at room temperature for the next four to eight weeks. Throughout the incubation period, monitor changes in the Winogradsky column at least once a week for the development of different colored layers and the formation of bubbles. Additionally, record the time it takes for different layers to develop.
Another modification that can be done is incubating the column near a radiator to select for thermophilic bacteria, or in a refrigerator to select for psychrophilic bacteria. Vary the light conditions by placing different columns in high light, low light, or darkness to incubate. Alternatively, limit the wavelength of incoming light by covering the column with different shades of cellophane to determine which colors select for different bacterial groups. For another optional experiment, to enrich iron-oxidizing bacteria, add a nail to the mud-water mixture prior to the addition of newspaper and an egg yolk.
After one to two weeks, growth of the cyanobacterial layer is indicated by a green or red-brown film on top of the mud layer of the classical Winogradsky column. Over time, the appearance and evolution of the different layers is monitored, each indicative of the different types of bacteria present. When comparing a column grown in the dark to a traditional Winogradsky column, we see the dark treatment yields the black layer at the bottom of the column, indicative of sulfate-reducing bacteria.
The dark column may also yield other layers, depending on other incubation conditions. Additionally, the dark column doesn’t yield the green cyanobacterial layer, nor the red, purple, or green layers indicative of purple non-sulfur, purple sulfur, and green sulfur bacteria respectively. These groups are dependent on light for growth.
