דילול סדרתי ו ציפוי: ספירה מיקרוביאלית
English
Diviser
Vue d'ensemble
מקור:ג’ונתןפ. בלייז 1 , אליזבת סוטר1, וכריסטופר פ קורבו1
1 המחלקה למדעי הביולוגיה, מכללת וגנר, דרך הקמפוס 1, סטטן איילנד ניו יורק, 10301
הערכה כמותית של פרוקריוטים יכולה להיות מכבידה בהתחשב בשפע שלהם, נטייתם להתפשטות מעריכית, מגוון מינים באוכלוסייה וצרכים פיזיולוגיים ספציפיים. בנוסף לאתגר זה, הוא הטבע הארבע-פאזי שבו חיידקים משתכפלים (עיכוב, יומן, נייח ומוות). היכולת להעריך במדויק את ריכוז המיקרואורגניזם נחוצה לזיהוי מוצלח, בידוד, טיפוח ואפיון (6). ככזה, מיקרוביולוגים השתמשו בדילול סדרתי וטכניקות ציפוי שונות במשך למעלה ממאה שנה כדי לכמת באופן אמין עומס חיידקי ויראלי בסביבות מעבדה קליניות, תעשייתיות, פרמצבטיות ואקדמאיות (2,4,6). תיאורים של מתודולוגיה זו הופיעו לראשונה בשנת 1883 כאשר המדען והרופא הגרמני רוברט קוך פרסם את עבודתו על סוכנים הגורמים למחלות זיהומיות (2). הטכניקות הידועות מראש של קוך, המכונות לעתים קרובות אבי הבקטריולוגיה המודרנית, הפכו לסטנדרט הזהב לספירת מיקרואורגניזמים, הניתנים לפולחן או אחר, ברחבי העולם.
דילול סדרתי הוא הפחתה שיטתית של ישות ידועה או לא ידועה (solute, אורגניזם, וכו ‘) באמצעות השעיה מחדש רצופה של פתרון ראשוני (פתרון0) לתוך נפחים קבועים של דילול נוזלי (ריק). החסרים האלה מורכבים בדרך כלל 0.45% מלוחים, אם כי הרכב יכול להיות מגוון (7). בעוד שנסיין יכול לבחור כל אמצעי אחסון עבור כל דילול, זה לרוב כפולה של 10, להקל על הפחתה לוגריתמית של המדגם. לדוגמה, פתרון0 מכיל סך של 100 תאי E. coli מושעים ב 10 מ”ל של מרק מיזיני. אם 1 מ”ל של פתרון0 מוסר ומתווסף 9 מ”ל של מלוחים (דילול1),הפתרון החדש (פתרון1)יכיל 1/10th של הריכוז הראשוני של E. coli. בדוגמה זו, הפתרון החדש (פתרון1) יכיל 10 תאי E. coli. חזרה על תהליך זה על ידי הסרת 1 מ”ל של פתרון1 והוספתו עוד 9 מ”ל של מלוחים (דילול2) יניב פתרון2, המכיל רק תא E. coli יחיד. מכיוון שכל פתרון חדש (9 מ”ל של דילול + 1 מ”ל של פתרון) מכיל סך של 10 מ”ל, אנו יכולים להסיק כי גורם הדילול להפחתה זו הוא 10 או שזה היה דילול סדרתי פי 10 (איור 1). מכיוון שהתחלנו רק עם 100 תאים בדוגמה זו ואנחנו מדללים בגורם של 10, רק שני שלבים נדרשים כדי להגיע לריכוז המינימלי המוחלט של תא אחד.
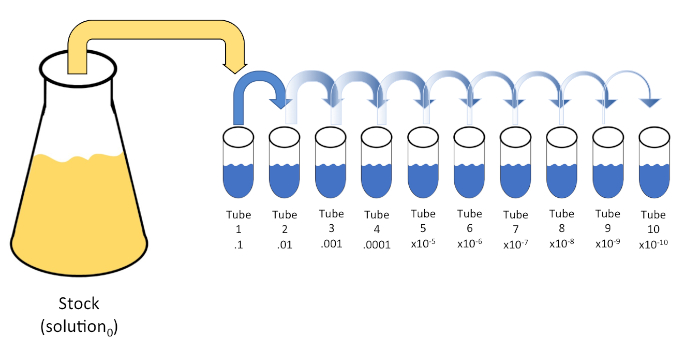
איור 1: דילול סדרתי של פתרון מניות. 1 מ”ל aliquot של פתרון המניה (פתרון0) מתווסף צינור 1 אשר מכיל 9 מ”ל של 0.45% מלוחים (dilent1); המוצר של תערובת זו הוא פתרון1. חזור על ידי aliquoting 1 מ”ל של פתרון חדש שנוצר1 והוספתו צינור 2. Aliquoting ו resuspension ממשיך בצורה זו עד הצינור הסופי הוא הגיע, דילול ריכוז המניה על ידי גורם של 10 כל אחד עם כל צעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
דילול סדרתי הוא הטכניקה הפשוטה ביותר להשגת ריכוזים לניהול של אורגניזם רצוי והוא משלים פסים של צלחת פטרי והתפשטות, רק שתיים מטכניקות ציפוי רבות המשמשות מיקרוביולוגים. יתרון זה של גישה זו הוא כי הנסיין יכול לקצור זנים טהורים של מין אחד או זנים נפרדים מאוכלוסייה מעורבת (7). פסים מתבצעים על ידי החדרת אורגניזם למדיום מוצק (בדרך כלל מורכב אגרוז) כי הוא יגדל על אם החומרים המזינים המתאימים זמינים. ניקוי עדין של לולאת חנק סטרילית על פני המדיום (כך שיישאר פס עדין) בתבנית סינוסואידית נוקשה, תפיץ את האורגניזם באופן פרופורציונלי לתדירות צורת הגל של הנסיין. חלוקת צלחת הפטרי לשליש או לרבעים (רצף רבעים) והפחתת התדירות של כל פס כאזור חדש של המנה נכנס בהדרגה להפחית את מספר מיקרואורגניזמים שיכולים לכבוש את האזור הזה, לייצר מושבות בודדות במקום דשא חיידקי בלתי ניתן לערעור. ציפוי ממרח אינו מדלל בנוסף דגימות; מפיץ זכוכית סטרילי משמש להפצת עליקוט של מדיית השעיה על פני צלחת פטרי שלמה(איור 2). המושבות הגדלות על צלחת ההתפשטות נובעות מתא יחיד וניתן לספור כל מושבה בצלחת כדי להעריך את מספר היחידות היוצרות מושבה למיליליטר (CFU) בהשעיה נתונה, המיוצגת כ- CFU / mL (6) (איור 3) אגר רך וציפוי משוכפל הם וריאציות של הטכניקות הנ”ל ומאפשרים בידוד של בקטריופאז ‘והקרנה מוטנטית, בהתאמה (1,7).
איור 2: צלחת פסים לספירת חיידקים ובידוד מתחים. סמן את תחתית צלחת הפטרי עם פרטי זיהוי (שם חיידק, תאריך, מדיה) וחלק לשליש. לאחר בחירת דילול מתאים של מדגם המלאי, לקחת לולאת חנק סטרילית (חד פעמית או להבה) ולהטביע אותו במבחנה (כאן, T3). להעלות מעט את כיסוי צלחת פטרי בצד אחד, כך רק לולאה מכחיק יכול לגשת אגר. גלה את הלולאה המחוסנת על פני החלק העליון של התקשורת בצורה זיג-זג נזהר לא להתפשר על אגר. סובב את הלוח בערך פי1/3 (~ 118°) והפחית את תדירות תנועת זיג-זג. סובב בפעם האחרונה והפחת את תדירות הזיג-זג פעם נוספת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
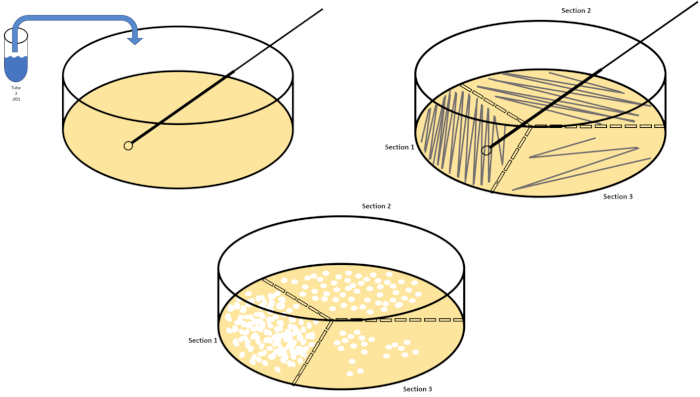
איור 3: למרוח ציפוי. גרם אחד של האזור האירובי היה תוחם מחדש ב- T1 ולאחר מכן מדולל באופן סדרתי. זכוכית סטרילית או מוט מתפשט חד פעמי פלסטיק משמש להפצת אינוקולום בכל מנה. זה חזר על עצמו עם 1 גרם של האזור אנאירובי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כמו בדילול סדרתי, קנה מידה לוגריתמי משמש כדי לבטא ריכוז אורגניזמי. ניתן למנות ידנית את מספר המושבות הגדלות בצלחות פטרי סטנדרטיות בגודל 100 מ”מ x15 מ”מ (או אוטומטיות בעזרת עיבוד חישובי) על ידי זיהוי אשכולות מבודדים של צמיחה. ספירות הכוללות פחות מ- 30 או יותר מ- 300 צריכות להיות מוגדרות כמעטות מכדי לספור (TFTC) או רבות מכדי לספור (TNTC), בהתאמה. במקרה של האחרון, דילול סדרתי צריך להתבצע כדי להפחית את הריכוז לפני restreaking צלחת פטרי חדשה. ממוצע מספר המושבות העצמאות שזוהו משלוש מנות פטרי נפרדות והכפלת הממוצע על ידי גורם הדילול יניבו CFU / mL; התווייתיומן 10 של CFU / mL נגד הזמן תחשוף את זמן הדור הממוצע של האורגניזם (7).
Procédure
Applications and Summary
Bacterial enumeration and strain isolation by plating requires manageable concentrations of target organisms. Successful plating is therefore contingent upon serial dilution. As such, the aforementioned techniques remain the cornerstone of microbiological examination and experimentation. Though simple by design, dilution factors and plating technique can be modified to by the experimenter to bolster outcomes without compromising the integrity of each method. Plotting the four phases of bacterial growth can be helpful when characterizing desired microbes. These phases, lag, log, stationary, and death, are marked by changes in bacterial replication. The lag phase features slow growth due to physiological adaptation, the log phase is the period of maximum proliferation featuring an exponential rise in viable cells, stationary phase is then reached due to environmental limitations and accumulations of toxins, before the death phase where cell counts begin to fall. This can be accomplished by serially diluting (or 1-step diluting to avoid confusion) Solution0 every hour for a total of 8 hours, beginning at Time0 (Solution0 should be returned to a shaking incubator after each dilution). Calculate the log10 of CFU/ml for a single diluent of Time0 and plot on the Y-axis. Repeat this calculation for the sample Time1 (make sure calculate CFU/mL using the same dilution factor as Time0). Repeat until each time (Time1-Time8) are plotted on the X-axis.
References
- Allen, M.E., Gyure, R.A. (2013) An Undergraduate Laboratory Activity Demonstrating Bacteriophage Specificity. Journal of Microbial Biological Education 14: 84-92.
- Ben-David, A., Davidson, C.E. (2014) Estimation Method for Serial Dilution Experiments. Journal of Microbiological Methods 107:214-221.
- Goldman, E., Green, L.H. (2008) Practical Handbook of Microbiology.
- Koch, R. (1883) New Research Methods for Detection of Microcosms in Soil, Air and Water.
- Lederberg, J., Lederberg, E.M. (1952) Replica Plating and Indirect Selection of Bacterial Mutants. Journal of Bacteriology 63:399-406
- Pepper, I., Gerba, C., Ikner, L. (2019) Bacterial Growth Curve Analysis and its Environmental Changes. JoVE Science Education Database. Environmental Microbiology.
- Sanders., E.R. (2012) Aseptic Laboratory Technique: Plating Methods. JoVE 63:e3063.
Transcription
Sometimes, in order to identify and study bacteria we first need to isolate and enrich them from a sample. For example, samples obtained from a Winogradsky Column are mixed, meaning they contain multiple species or strains of bacteria, so studying an individual bacterium or enumerating the different kinds present can be challenging. To this end, serial dilution and plating techniques are typically employed to reliably quantify bacterial load and isolate individual colonies.
Serial dilution is a process through which the concentration of an organism, bacteria in this example, is systematically reduced through successive resuspension in fixed volumes of liquid diluent. Usually the volume of the diluent is a multiple of 10 to facilitate logarithmic reduction of the sample organism. For example, one gram of sediment is first removed from the Winogradsky zone of interest and added to 10 milliliters of an appropriate liquid medium. Then, one milliliter of this first dilution is added to another tube containing nine milliliters of medium. The process can be repeated until several different concentrations of bacteria have been prepared. Serial dilution is the key to enumeration of bacteria in this example, since mixed samples from a Winogradsky Column contain an unknown, often large, number of bacteria.
Next, streak plating and spread plating enable the isolation and enumeration of bacteria within a sample, respectively. Streaking is accomplished by introducing a diluted sample to one section of the solid medium supplemented with nutrient, which is divided into thirds. This inoculum is then spread over each third of the plate in a zig-zag pattern. As different sections of the plate are streaked, crossing from the previous sample only once, the sample is spread more thinly. This means that you may only need to streak from one dilution to achieve individual colonies in the later sections. After incubation, the streaked plates allow for observations of colony morphology, information that can help differentiate between different bacterial species.
Alternatively, if the main goal is the enumeration of the bacteria in the sample spread plating may be used. In spread plating, an aliquot of a single sample is spread evenly over the entire surface of solid medium. Typically, because we don’t know the bacterial numbers in the mixed sample, a spread plate is made for each of the dilutions or a representative sample of them. After incubation, enumeration can be performed using these spread plates. Any plates with colony counts fewer than 30 should be discarded, since small counts are subject to greater error. Similarly, any counts over 300 should be discarded because colony crowding and overlapping can lead to underestimation of colony count. If the colony counts of each of these remaining dishes is recorded and multiplied by the dilution factor, and then divided by the volume plated, this yields the colony forming units, or CFUs, per milliliter of suspension. In this video, you will learn how to qualitatively and quantitatively evaluate a sample containing a known bacterium, and the microbial communities contained in various regions of a Winogradsky Column via serial dilution, spread plating, and streak plating.
First, put on any appropriate personal protective equipment including a lab coat, gloves, and goggles. Next, sterilize the workspace with 70% ethanol and wipe down the surface. Next, gather two 500 milliliter Erlenmeyer flasks and label one broth and the other agar. To prepare LB agar solution, mix approximately 6.25 grams of LB agar, three grams of technical agar, and 250 milliliters of distilled water in the flask labeled agar.
Then, prepare LB broth by combining 2. 5 grams of LB media and 100 milliliters of distilled water in the flask labeled broth. After autoclaving the flasks, use a heat resistant glove to remove the flasks from the autoclave and place them in a 40 to 50 degree Celsius water bath. Once the flasks are 50 degrees Celsius, carefully prepare three 100 milliliter aliquots of the broth solution and label each aliquot solution zero. Next, gather 10 sterile petri dishes and label them with the date, name, type of media used, and the Winogradsky Column zone that the organisms will be harvested from. Pipette 15 milliliters of agar from the agar flask into each petri dish. Then, use the pipette tip to remove any bubbles, replace the plate lids, and allow them to solidify on the bench top overnight.
The next day, wipe down the bench top with 70% ethanol. Next, label 10 20 milliliter test tubes T1 through T10 and place them in a rack. Pipette nine milliliters of .45% saline into each tube. Now, cover each of the 10 test tubes loosely with their caps and transfer them to an autoclave-compatible test tube rack. After the cycle is complete, remove the saline blanks using heat resistant gloves and allow them to cool. Store the tubes at room temperature until they have reached approximately 22 degrees Celsius.
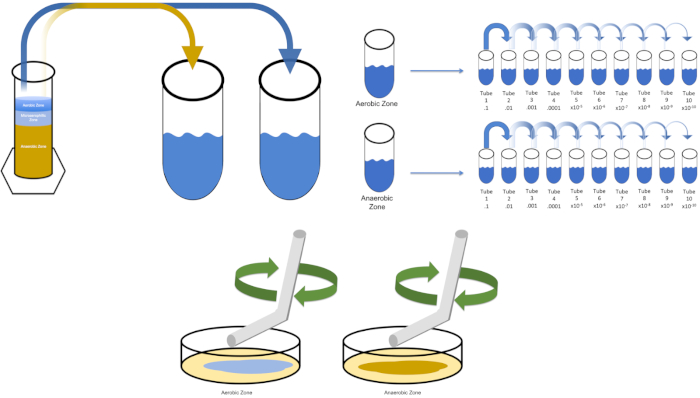
To cultivate a known target organism, E. coli in this example, inoculate 100 milliliters of solution zero with a single colony from a previously streaked plate. Then, cover the tube and incubate it over night at 37 degrees Celsius. To evaluate the regions of a Winogradsky Column, add approximately one gram of material from the aerobic zone to T1 and resuspend by vortexing. Then, repeat this process with one gram of material from the anaerobic zone.
Remove the tube containing solution zero inoculated with E. coli from the incubator and shake it. Then, pipette one milliliter of the solution into a T1 test tube and vortex to mix. Remove one milliliter of solution from T1 and transfer it to T2, vortexing to mix. Repeat this process through tube T10. To evaluate the aerobic and anaerobic zones of the Winogradsky Column, remove one milliliter of solution from each of the previously prepared T1 tubes and transfer it to the appropriate T2 tubes. Then, continue the serial dilutions through the T10 tubes as previously demonstrated.
To spread plate, pipette 100 microliters of the diluted sample from each T3 tube on to the corresponding petri dish. Then, use a sterile spreading rod to gently distribute the sample on to the petri dish and replace the plate lid. Repeat this process for the T6 and T9 dilutions, as previously demonstrated. Incubate the plates containing aerobic organisms in a 37 degree Celsius incubator for 24 hours. Incubate the plates containing anaerobic organisms in an anaerobic chamber set to 37 degrees Celsius for 24 hours. The next day remove the T3, T6, and T9 dilution plates from the incubator and the anaerobic chamber and transfer them to the bench top. Working with one plate at a time, glide a sterile inoculating loop across the top of the media in a zig-zag pattern. Then, replace the petri dish lid. Next, rotate the plate by 1/3 and sterilize the loop to reduce the frequency of the previously made zig-zag pattern. Again, after sterilizing the loop, rotate the plate by 1/3, reduce the frequency of the zig-zag pattern one last time, and replace the lid. Repeat this streaking method for the remaining plates, as previously shown. Then, place the streaked plates containing aerobic organisms in a 37 degree Celsius incubator overnight and the streaked plates containing anaerobic organisms in an anaerobic chamber set to 37 degrees Celsius overnight.
Cultures were harvested from the aerobic and anaerobic zones of a seven day Winogradsky Column. Then, the cultures were serially diluted prior to streaking and spreading on LB agar plates. Streaking revealed a mixed population from each of the evaluated Winogradsky zones, and the spread plates produced similar results. A plate streaked from a mixed population will result in bacterial colonies of different shapes, sizes, textures, and colors. In contrast, the streaked and spread plates containing the known organism, E. coli, demonstrated a homologous population. Generally, it is best to calculate CFUs per milliliter using the average colony count of three plates spread with the same sample and dilution factor. Multiply the average number of colonies by the dilution factor and divide by the amount aliquoted. Finally, isolated colonies chosen from each plate can be used in further enrichment assays to determine species identity.
