4.1:
Stechiometria di reazione
4.1:
Stechiometria di reazione
Un’equazione chimica equilibrata fornisce una grande quantità di informazioni in un formato molto conciso. Le formule chimiche forniscono l’identità dei reagenti e dei prodotti coinvolti nel cambiamento chimico, consentendo la classificazione della reazione. I coefficienti forniscono il numero relativo di queste specie chimiche, consentendo una valutazione quantitativa delle relazioni tra le quantità di sostanze consumate e prodotte dalla reazione. Queste relazioni quantitative sono note come stechiometria della reazione, un termine derivato dalle parole greche stoicheion (che significa “elemento”) e metron (che significa “misura”).
La stechiometria di una reazione aiuta a prevedere quanto del reagente è necessario per produrre la quantità desiderata di prodotto o, in alcuni casi, quanto prodotto si formerà da una quantità specifica del reagente.
Coefficienti stechiometrici
I coefficienti di un’equazione chimica rappresentano il numero di talpe di ogni sostanza. Ad esempio, si consideri la reazione del gas azoto e del gas idrogeno per produrre ammoniaca. La stechiometria indica che una talpa di azoto e tre talpe di idrogeno reagiscono per produrre due talpe di ammoniaca.

Poiché una talpa contiene il numero di molecole di Avogadro, il numero relativo di molecole è lo stesso del numero relativo di talpe. Un modo alternativo di leggere l’equazione è “una molecola di azoto e tre molecole di idrogeno reagiscono per produrre due molecole di ammoniaca”.
Fattori stechiometrici
Le equazioni chimiche bilanciate sono usate per determinare la quantità di un reagente necessario per reagire con una data quantità di un altro reagente, o per produrre una data quantità di prodotto, e così via. I coefficienti nell’equazione bilanciata sono usati per derivare fattori stechiometrici che consentono il calcolo della quantità desiderata. Nella reazione dell’idrogeno e dell’azoto, le molecole di ammoniaca sono prodotte da molecole di idrogeno in un rapporto 2:3. Ciò significa che tre talpe di idrogeno sono stochiometricamente equivalenti a due talpe di ammoniaca.
Sulla base di questo, derivano i seguenti fattori stechiometrici:
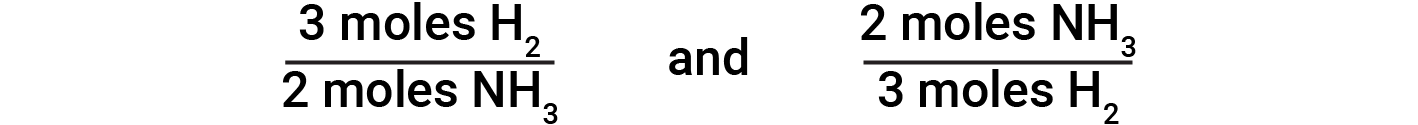
Questi fattori stechiometrici possono essere usati per calcolare il numero di molecole di ammoniaca prodotte da un dato numero di molecole di idrogeno, o il numero di molecole di idrogeno necessarie per produrre un dato numero di molecole di ammoniaca. Fattori simili possono essere derivati per qualsiasi coppia di sostanze in qualsiasi equazione chimica.
Conversioni da talpa a talpa
Per una reazione chimica equilibrata per la formazione di ammoniaca da azoto e idrogeno, il seguente rapporto di talpa stechiometrica tra N2 e NH3 è 1:2. Quindi, la quantità molare di ammoniaca viene derivata moltiplicando la quantità molare di azoto per il fattore di conversione stechiometrico relativo alle due sostanze di interesse.

Conversioni da massa a massa
La conversione tra masse di sostanze a base di stechiometria richiede la conoscenza dei rapporti talpa e delle masse molare. Ad esempio, per trovare la massa di idrogeno necessaria per produrre 0,170 kg di ammoniaca, in primo luogo, la massa molare di ammoniaca viene utilizzata per convertire la massa di ammoniaca nella quantità di ammoniaca (nelle talpe). Quindi, il fattore stechiometrico appropriato dall’equazione bilanciata converte la quantità di ammoniaca (nelle talpe) nella quantità di idrogeno (nelle talpe). Infine, la massa molare dell’idrogeno converte la quantità di idrogeno (in talpe) nella massa di idrogeno.
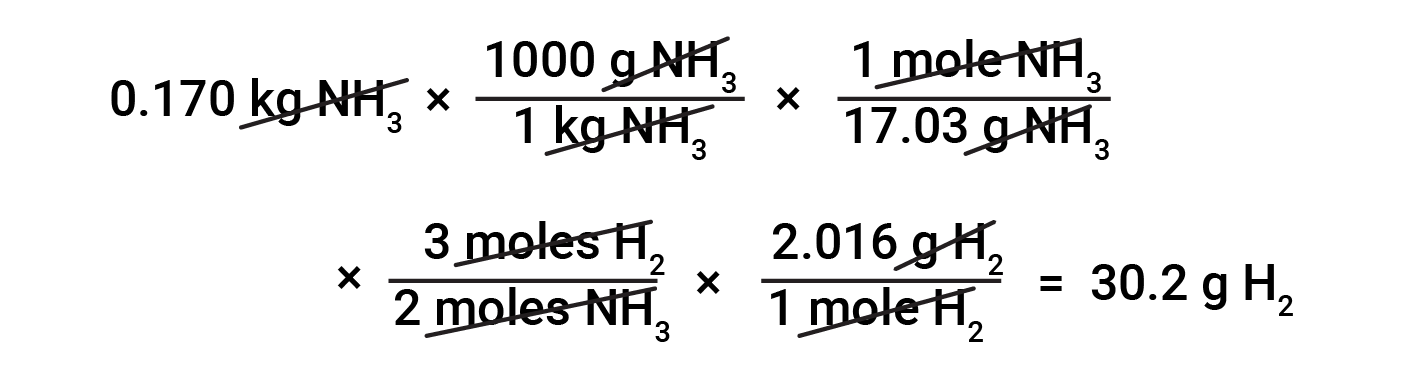
Numerose variazioni sui passaggi computazionali iniziale e finale sono possibili a seconda delle quantità particolari fornite e ricercate (volumi, concentrazioni di soluzioni e così via). Indipendentemente dai dettagli, tutti questi calcoli condividono una componente essenziale comune: l’uso di fattori stechiometrici derivati da equazioni chimiche bilanciate.
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 4.3: Reaction Stoichiometry.
