4.5:
Concentrazione e diluizione della soluzione
4.5:
Concentrazione e diluizione della soluzione
La quantità relativa di un dato componente della soluzione è nota come concentrazione. Spesso, anche se non sempre, una soluzione contiene un componente con una concentrazione significativamente maggiore di quella di tutti gli altri componenti. Questo componente è chiamato solvente e può essere visto come il mezzo in cui gli altri componenti sono dispersi o sciolti. Le soluzioni in cui l’acqua è il solvente sono, ovviamente, molto comuni sul nostro pianeta. Una soluzione in cui l’acqua è il solvente è chiamata soluzione acquosa.
Un soluto è un componente di una soluzione che è tipicamente presente ad una concentrazione molto inferiore rispetto al solvente. Le concentrazioni di soluto sono spesso descritte con termini qualitativi come diluito (di concentrazione relativamente bassa) e concentrato (di concentrazione relativamente elevata).
Le concentrazioni possono essere valutate quantitativamente utilizzando un’ampia varietà di unità di misura, ciascuna conveniente per particolari applicazioni. La molarità(M)è un’utile unità di concentrazione per molte applicazioni in chimica. La molarità è definita come il numero di talpe di soluto esattamente in 1 litro (1 L) della soluzione e ha le unità di ‘mol/L’.
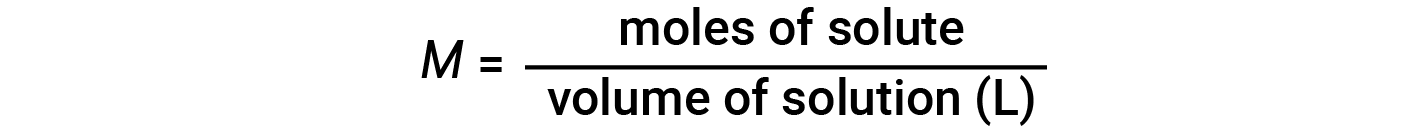
Si noti che nell’equazione di molarità, viene utilizzato il volume della soluzione e non il volume del solvente. Questo perché, a seconda della natura delle interazioni tra il soluto e il solvente, il soluto può cambiare il volume della soluzione. Quindi, nell’equazione della molarità, usiamo il volume totale della soluzione (cioè volume di solvente + volume di soluto). Poiché i volumi della soluzione variano con la temperatura, anche le concentrazioni molare varieranno. Se espressa in molarità, la concentrazione di una soluzione con un numero identico di specie di soluto e solvente sarà diversa a temperature diverse, a causa della contrazione/espansione della soluzione.
Diluizione delle soluzioni
La diluizione è il processo mediante il quale una soluzione viene resa meno concentrata (o più diluita) dall’aggiunta di solvente. Ad esempio, un bicchiere di caffè freddo diventa sempre più diluito e meno dolce man mano che il ghiaccio si scioglie. Nei laboratori, le soluzioni sono spesso immagazzinate nelle loro forme concentrate, chiamate soluzioni stock. Le soluzioni di concentrazioni più basse vengono preparate dallo stock attraverso la diluizione.
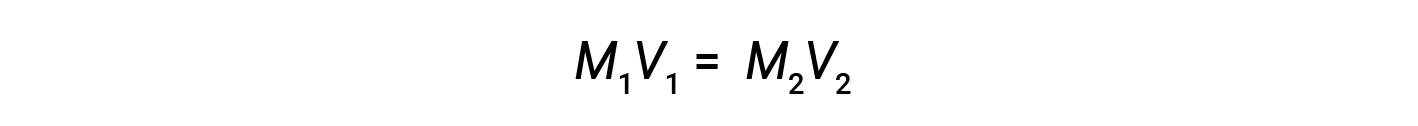
dove M e V sono rispettivamente concentrazione e volume, e i pedici “1” e “2” si riferiscono rispettivamente alla soluzione prima e dopo la diluizione.
Ora, poiché il prodotto di molarità e volume equivale a talpe, il numero di talpe prima e dopo la diluizione rimane lo stesso.
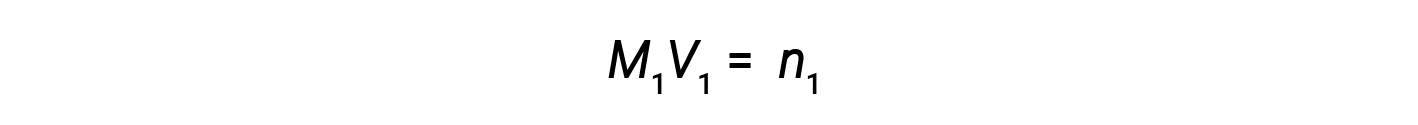
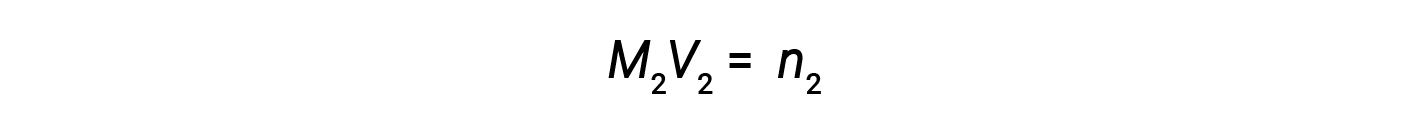
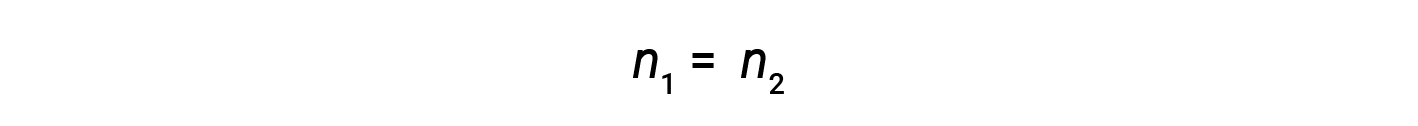
Pertanto, la diluizione non modifica la quantità di soluto nella soluzione.
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 3.3: Molarity.
