5.3:
Applicazione della legge dei gas ideali: massa molare, densità e volume
5.3:
Applicazione della legge dei gas ideali: massa molare, densità e volume
Il volume occupato da una talpa di una sostanza è il suo volume molare. La legge del gas ideale, PV = nRT, suggerisce che il volume di una data quantità di gas e il numero di talpe in un dato volume di gas variano con le variazioni di pressione e temperatura. A temperatura e pressione standard, o STP (273,15 K e 1 atm), una talpa di un gas ideale (indipendentemente dalla sua identità) ha un volume di circa 22,4 L – questo è indicato come il volume molare standard.
Ad esempio, una talpa ciascuno di idrogeno, ossigeno, argon o anidride carbonica occupa 22,4 litri a STP. Ciò implica che 0,5 moli di qualsiasi gas a STP occupano un volume di 11,2 L, e allo stesso modo, 2 talpe di qualsiasi gas a STP occupano un volume di 44,8 L.
La legge del gas ideale è universale, che riguarda la pressione, il volume, il numero di talpe e la temperatura di un gas indipendentemente dall’identità chimica del gas:
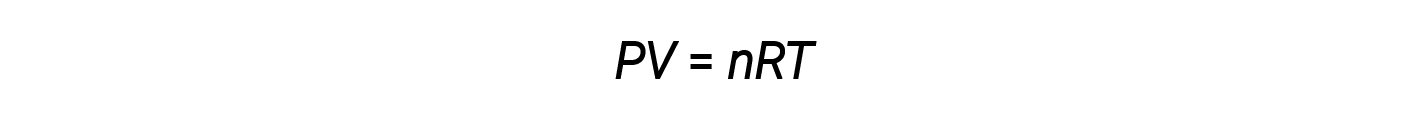
La densità d di un gas, d’altra parte, è determinata dalla sua identità. La densità è il rapporto tra massa e volume. Riordinando l’equazione del gas ideale per isolare V e sostituendosi nell’equazione di densità si ottiene:
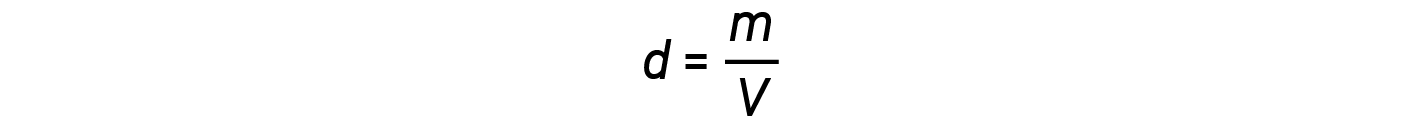
Il rapporto m/n cioè massa su talpe, è la definizione di massa molare, M:
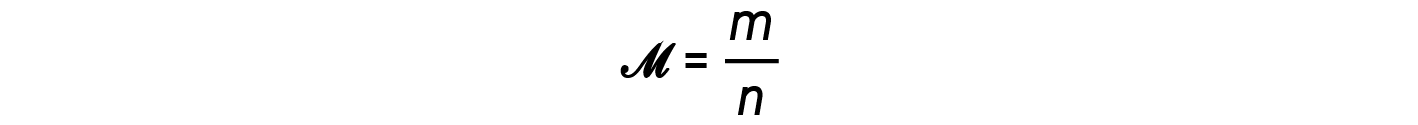
L’equazione di densità può quindi essere scritta come
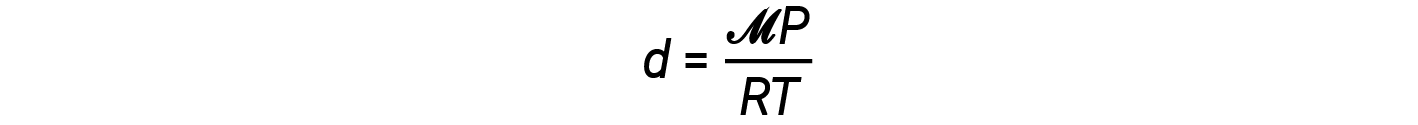
Questa equazione ci dice che la densità del gas è direttamente proporzionale alla pressione e alla massa molare, e inversamente proporzionale alla temperatura. Ad esempio, CO2 (massa molare = 44 g/mol) è più pesante di N2 (massa molare = 28 g/mol) o O2 (massa molare = 32 g/mol), ed è quindi più densa dell’aria. Per questo motivo, la CO2 rilasciata da unestintore di CO 2 copre un incendio, impedendo a O2 di raggiungere il materiale combustibile. Il fenomeno del sollevamento delle mongolfiere dipende dalla relazione che i gas di masse molare uguali (come l’aria) hanno densità più basse a temperature più elevate, e quindi le mongolfiere possono galleggiare.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 9.3: Stechiometria di sostanze gassose, miscele e reazioni.
