6.7:
Equazioni termochimiche
6.7:
Equazioni termochimiche
Per una reazione chimica (il sistema) effettuata a pressione costante – con l’unico lavoro fatto causato dall’espansione o dalla contrazione – l’entalpia di reazione (chiamata anche calore di reazione, ΔHrxn) è uguale al calore scambiato con l’ambiente circostante (qp).
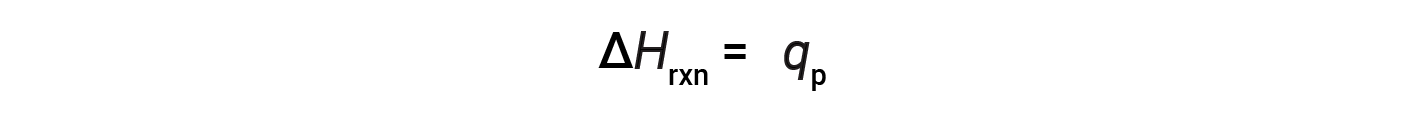
Il cambiamento nell’entalpia è una proprietà estesa e dipende dalle quantità dei reagenti che partecipano alla reazione (o dal numero di talpe di reagenti). Il cambiamento dell’entalpia è specifico della reazione e gli stati fisici del reagente e delle specie di prodotto sono importanti. Una reazione esotermica è caratterizzata da un valore di −ΔHrxn, mentre una reazione endotermica ha un valore di +ΔHrxn.
Poiché la quantità di calore rilasciata o assorbita da una reazione corrisponde alla quantità di ogni sostanza consumata o prodotta dalla reazione, è conveniente usare un’equazione termochimica per rappresentare i cambiamenti sia nella materia che nell’energia. In un’equazione termochimica, il cambiamento nell’entalpia di una reazione è mostrato come ΔHrxn, ed è generalmente fornito seguendo l’equazione per la reazione. La magnitudine di ΔHrxn indica la quantità di calore associata alla reazione mostrata nell’equazione chimica. Il segno di ΔHrxn indica se la reazione è esotermica o endotermica, come scritto. Nell’equazione seguente, 1 talpa di idrogeno gassoso e 1/2 talpa di gas ossigeno (ad una certa temperatura e pressione) reagiscono per formare 1 talpa di acqua liquida (alla stessa temperatura e pressione).
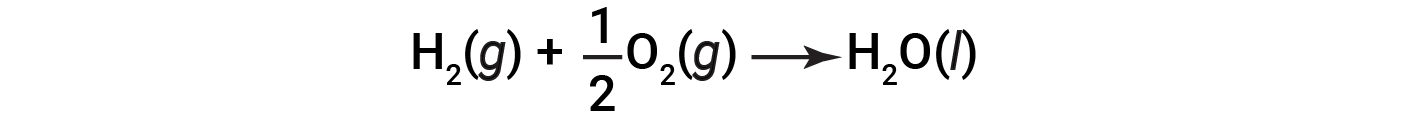
Questa equazione indica che 286 kJ di calore vengono rilasciati nell’ambiente circostante. In altre parole, vengono rilasciati 286 kJ di calore (la reazione è esotermica) per ogni talpa di idrogeno che viene consumata o per ogni talpa d’acqua prodotta. Pertanto, l’entalpia di reazione è un fattore di conversione che può essere utilizzato per calcolare la quantità di calore che viene rilasciato o assorbito durante le reazioni che coinvolgono quantità specifiche di reagenti e prodotti.
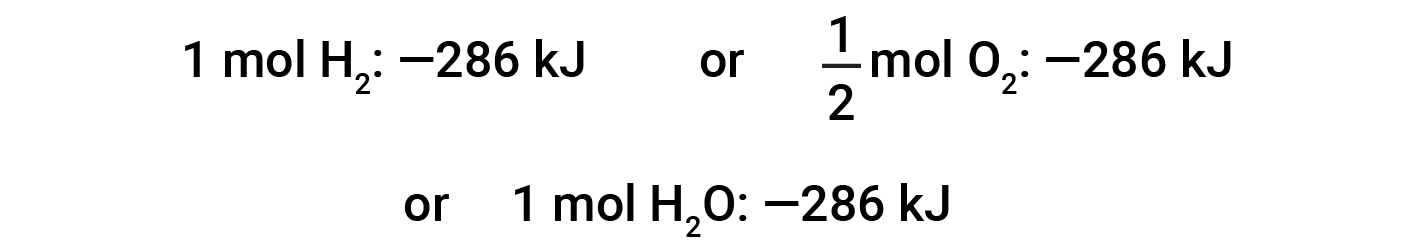
Se i coefficienti dell’equazione chimica sono moltiplicati per qualche fattore (cioè, se la quantità di una sostanza viene modificata), la variazione dell’entalpia deve essere moltiplicata per lo stesso fattore.
(aumento di due volte degli importi)
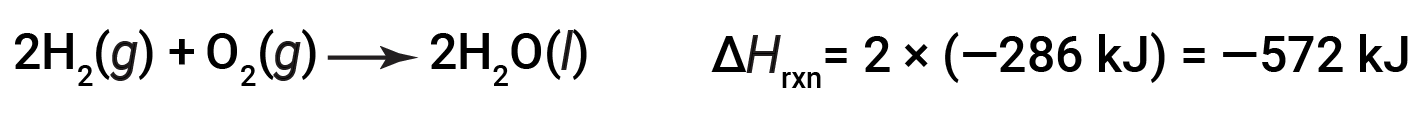
(diminuzione di due volte degli importi)
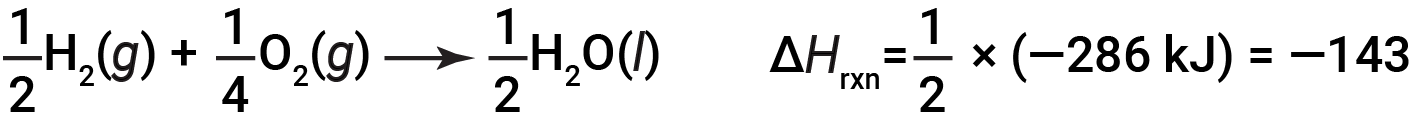
Per illustrare che il cambiamento di entalpia di una reazione dipende dagli stati fisici dei reagenti e dei prodotti, considerare la formazione di acqua gassosa (o vapore acqueo). Quando 1 talpa di idrogeno gassoso e 1/2 mole di gas ossigeno reagiscono per formare 1 talpa di acqua gassosa, vengono rilasciati solo 242 kJ di calore, contro i 286 kJ di calore, che viene rilasciato quando si forma acqua liquida.
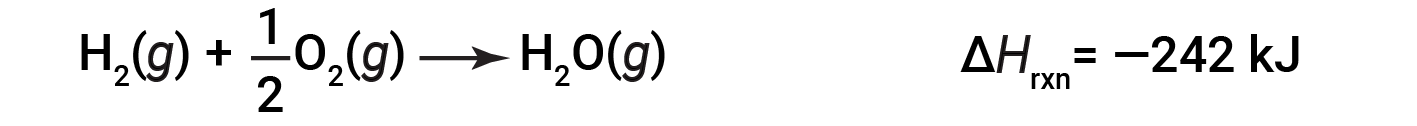
Suggested Reading
- Canagaratna, Sebastian G. "A visual aid in enthalpy calculations." Journal of Chemical Education 77, no. 9 (2000): 1178.
- Keifer, David. "Enthalpy and the Second Law of Thermodynamics." Journal of Chemical Education 96, no. 7 (2019): 1407-1411.
- Khalil, Mutasim I. "Calculating enthalpy of reaction by a matrix method." Journal of Chemical Education 77, no. 2 (2000): 185.
