7.4:
Effetto fotoelettrico
7.4:
Effetto fotoelettrico
Quando la luce di una particolare lunghezza d’onda colpisce una superficie metallica, gli elettroni vengono emessi. Questo è chiamato effetto fotoelettrico. La frequenza minima della luce che può causare tale emissione di elettroni è chiamata frequenza di soglia, che è specifica del metallo. La luce con una frequenza inferiore alla frequenza di soglia, anche se è di alta intensità, non può avviare l’emissione di elettroni. Tuttavia, quando la frequenza è superiore al valore soglia, il numero di elettroni espulsi è direttamente proporzionale all’intensità del fascio.
Secondo la teoria classica delle onde, l’energia di un’onda dipende dalla sua intensità (che dipende dalla sua ampiezza), non dalla sua frequenza. Una parte di queste osservazioni era che il numero di elettroni espulsi in un dato periodo di tempo era visto aumentare con l’aumentare della luminosità. Nel 1905, Albert Einstein fu in grado di risolvere il paradosso incorporando i risultati della quantizzazione di Planck nella screditata visione delle particelle della luce.
Einstein sosteneva che le energie quantizzate che Planck aveva postulato potevano essere applicate alla luce nell’effetto fotoelettrico. La luce che colpisce la superficie metallica non dovrebbe essere vista come un’onda, ma dovrebbe invece essere vista come un flusso di particelle (in seguito chiamate fotoni) la cui energia dipendeva dalla loro frequenza, La quantità di energia (E) in un pacchetto luminoso dipende dalla sua frequenza (ν) secondo la seguente equazione:
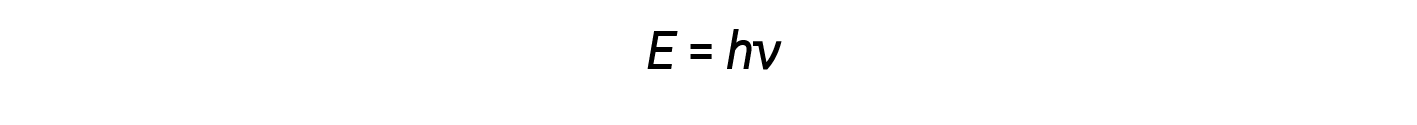
dove h è la costante di Planck.
L’effetto fotoelettrico può essere descritto assumendo che la luce sia quantizzata. Una certa energia minima è necessaria per superare l’energia di legame (Φ) sperimentata da un elettrone. Questa è anche nota come funzione di lavoro (W) del metallo.
Poiché gli elettroni nel metallo avevano una certa quantità di energia legante che li teneva lì, la luce incidente ha bisogno di avere più energia per liberare gli elettroni. I fotoni di luce a bassa frequenza non contengono abbastanza energia per espellere elettroni dal metallo. Anche se il metallo è esposto a tale luce per lungo tempo, non si osserva alcuna emissione di elettroni. Un elettrone può essere emesso solo quando un fotone con energia maggiore della funzione di lavoro colpisce il metallo.

L’energia in eccesso del fotone viene convertita in energia cinetica dell’elettrone emesso.
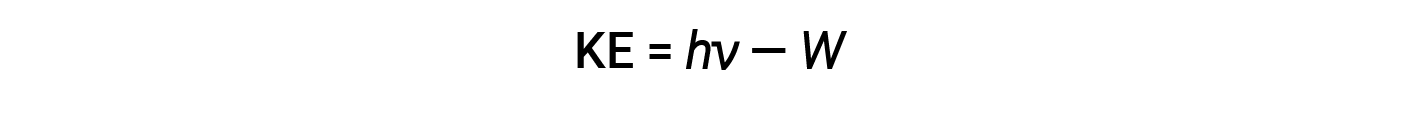
Pertanto, gli elettroni vengono espulsi quando vengono colpiti da fotoni con energia sufficiente (una frequenza maggiore della soglia). Maggiore è la frequenza della luce incidente, maggiore è l’energia cinetica impartita dalle collisioni agli elettroni in fuga. Einstein sosteneva anche che l’intensità della luce non dipendeva dall’ampiezza dell’onda in arrivo, ma corrispondeva invece al numero di fotoni che colpivano la superficie entro un dato periodo di tempo. Il numero di elettroni espulsi aumenta con la luminosità. Maggiore è il numero di fotoni in arrivo, maggiore è la probabilità che collidano con alcuni elettroni.
L’effetto fotoelettrico suggerisce fortemente il comportamento delle particelle della luce. Einstein vinse il Premio Nobel per la fisica nel 1921 per la sua spiegazione dell’effetto fotoelettrico. Sebbene molti fenomeni di luce potessero essere spiegati in termini di onde o particelle, alcuni fenomeni, come i modelli di interferenza ottenuti quando la luce passava attraverso una doppia fessura, erano completamente contrari a una visione particellare della luce, mentre altri fenomeni, come l’effetto fotoelettrico, erano completamente contrari a una visione d’onda della luce. In qualche modo, ad un livello fondamentale profondo ancora non completamente compreso, la luce è sia wavelike che particle-like. Questa è nota come dualità onda-particella.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 6.1: Energia Elettromagnetica.
