7.7:
La lunghezza d'onda di de Broglie
7.7:
La lunghezza d'onda di de Broglie
Nel mondo macroscopico, gli oggetti abbastanza grandi da essere visti ad occhio nudo seguono le regole della fisica classica. Una palla da biliardo che si muove su un tavolo si comporterà come una particella; continuerà a viaggiare in linea retta a meno che non si scontri con un’altra palla, o sia agito da qualche altra forza, come l’attrito. La palla ha una posizione e una velocità ben definite o un momento ben definito, p = mv, che è definito da massa m e velocità v in un dato momento. Questo è il comportamento tipico di un oggetto classico.
Quando le onde interagiscono tra loro, mostrano schemi di interferenza che non sono visualizzati da particelle macroscopiche, come la palla da biliardo. Tuttavia, negli anni ’20, divenne sempre più chiaro che piccoli pezzi di materia seguono un diverso insieme di regole rispetto ai grandi oggetti. Nel mondo microscopico, onde e particelle sono inseparabili.
Una delle prime persone a prestare attenzione al comportamento speciale del mondo microscopico fu Louis de Broglie. Ha messo in dubbio che se la radiazione elettromagnetica può avere un carattere simile a una particella, gli elettroni e altre particelle submicroscopiche possono mostrare carattere ondoso? De Broglie estese la dualità onda-particella della luce che Einstein usò per risolvere il paradosso dell’effetto fotoelettrico alle particelle materiali. Predisse che una particella con massa m e velocità v (cioè con momento lineare p) dovrebbe anche mostrare il comportamento di un’onda con un valore di lunghezza d’onda λ, dato da questa espressione in cui h è la costante di Planck:

Questa è chiamata lunghezza d’onda de Broglie. Quando Bohr aveva postulato che l’elettrone fosse una particella che orbita attorno al nucleo in orbite quantizzate, de Broglie sostenne che l’ipotesi di Quantizzazione di Bohr poteva essere spiegata se l’elettrone fosse invece considerato un’onda permanente circolare. Solo un numero intero di lunghezze d’onda potrebbe stare esattamente all’interno dell’orbita.
Se un elettrone è visto come un’onda che gira attorno al nucleo, un numero intero di lunghezze d’onda deve adattarsi all’orbita affinché questo comportamento di onda permanente sia possibile.
Per un’orbita circolare di raggio r, la circonferenza è 2πr, e quindi la condizione di de Broglie è:
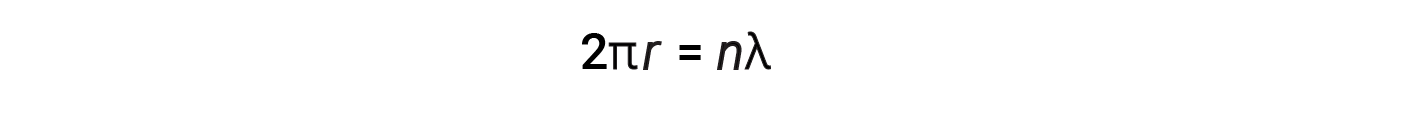
dove n = 1, 2, 3, e così via. Poco dopo che de Broglie propose la natura ondoso della materia, due scienziati dei Bell Laboratories, C. J. Davisson e L. H. Germer, dimostrarono sperimentalmente che gli elettroni potevano mostrare un comportamento ondoso. Ciò è stato dimostrato puntando un fascio di elettroni su un bersaglio cristallino di nichel. La spaziatura degli atomi all’interno del reticolo era approssimativamente la stessa delle lunghezze d’onda di de Broglie degli elettroni che gli venivano puntati, e gli strati atomici regolarmente distanziati del cristallo servivano come “fessure”, che viene utilizzato in altri esperimenti di interferenza.
Inizialmente, quando sono stati registrati solo pochi elettroni, è stato osservato un chiaro comportamento simile a una particella. Man mano che sempre più elettroni arrivavano e venivano registrati, emerse un chiaro modello di interferenza, che è il segno distintivo del comportamento wavelike. Così, sembra che mentre gli elettroni sono piccole particelle localizzate, il loro moto non segue le equazioni di moto implicite nella meccanica classica. Invece, il loro moto è governato da un’equazione d’onda. Quindi, la dualità onda-particella osservata per la prima volta con i fotoni è un comportamento fondamentale, intrinseco a tutte le particelle quantistiche.
Questo testo è adattato da Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
