7.11:
Orbitali atomici
7.11:
Orbitali atomici
Un orbitale atomico rappresenta le regioni tridimensionali in un atomo in cui un elettrone ha la più alta probabilità di risiedere. La funzione di distribuzione radiale indica la probabilità totale di trovare un elettrone all’interno del guscio sottile ad una distanza r dal nucleo. Gli orbitali atomici hanno forme distinte che sono determinate da l, il numero quantico momento angolare. Gli orbitali sono spesso disegnati con una superficie limite, che racchiude regioni più dense della nube.
Il numero quantico momento angolare è un intero che può assumere i valori, l = 0, 1, 2, …, n – 1. Un orbitale con un numero quantico principale di 1 (n = 1) può avere un solo valore di l (l = 0), mentre un numero quantico principale di 2 (n = 2) permette l = 0 e l = 1. Gli orbitali con lo stesso valore di l definiscono una sottoshell.
Gli orbitali con l = 0 sono chiamati orbitali s e covano le subshell s. Il valore l = 1 corrisponde agli orbitali p. Per un dato n, gli orbitali p costituiscono una subshell p (cioè 3p se n = 3). Gli orbitali con l = 2 sono chiamati orbitali d. Gli orbitali con l = 3, 4 e 5 sono gli orbitali f, g e h.
L’orbitale a più bassa energia è l’orbitale1 s. Questo è un orbitale sfericamente simmetrico. La densità di probabilità (ψ2) di un orbitale di 1s implica che è più probabile che l’elettrone si trova nel nucleo. Tuttavia, date le forze elettrostatiche tra protoni ed elettroni, questo non rappresenta accuratamente dove risiederà l’elettrone. Invece, viene utilizzata la funzione di distribuzione radiale, che è un grafico della probabilità totale di trovare un elettrone in un orbitale ad un dato raggio r. La funzione di distribuzione radiale si trova moltiplicando la densità di probabilità per il volume di sottili gusci sferici con raggi, r. Per l’orbitale 1s dell’idrogeno, la funzione di distribuzione radiale ha un valore zero nel nucleo, che aumenta ad un massimo di 52,9 picometri prima di diminuire con l’aumento di r.
Ci sono alcune distanze dal nucleo a cui la densità di probabilità di trovare un elettrone situato su un particolare orbitale è zero. In altre parole, il valore della funzione d’onda ψ è zero a questa distanza per questo orbitale. Tale valore di r è chiamato nodo radiale. Il numero di nodi radiali in un orbitale è n – l – 1. Per gliorbitali 2 s, dove n = 1, c’è un nodo radiale, mentre gliorbitali 3 s hanno due nodi radiali.
Ogni livello principale con n = 2 o più contiene tre orbitali p. Gli orbitali a tre p hanno due lobi con un nodo situato al nucleo. L’orientamento degli orbitali p nello spazio è descritto dal valore di ml. Gli orbitali a tre p sono reciprocamente perpendicolari (ortogonali) l’uno all’altro. Gli orbitali p più alti (3p, 4p, 5pe superiore) hanno forme simili ma hanno dimensioni maggiori con nodi radiali aggiuntivi.
I livelli principali con n = 3 o più contengono cinque orbitali d. Quattro di questi orbitali sono costituiti da una forma a quadrifoglio, con quattro lobi ad alta densità di elettroni. Ci sono due piani nodali perpendicolari che si intersecano al nucleo. A questi piani nodali, la densità degli elettroni è zero. Uno degli orbitali d ha una forma leggermente diversa e ha due lobi orientati nell’asse zcon un anello a forma di ciambella nel piano xy. I livelli principali con n = 4 e superiore contengono sette orbitali f, che hanno forme complesse. Questi orbitali hanno più nodi e lobi degli orbitali d.
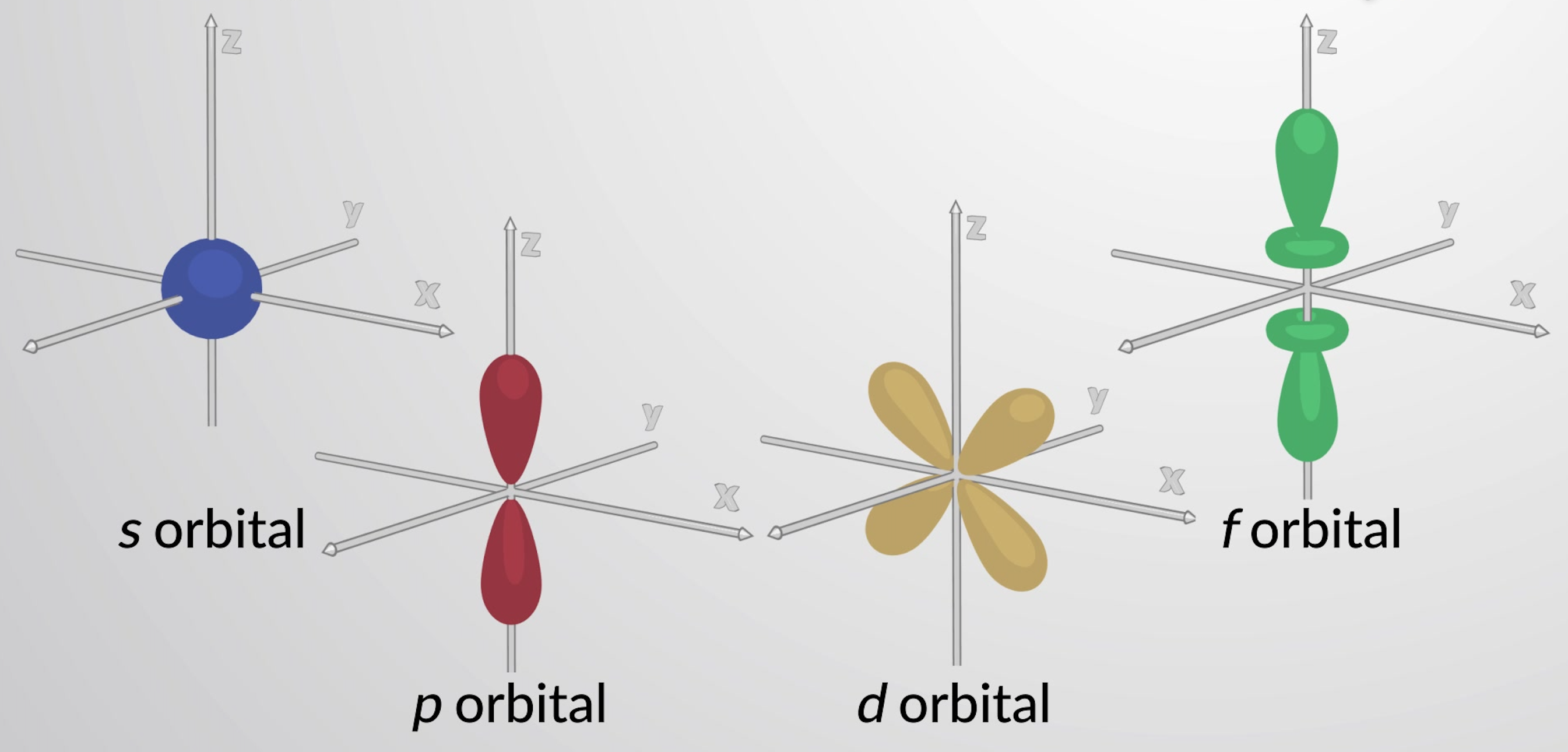
Figura 1: Orbitali rappresentativi s, p , d e f.
Queste diverse forme degli orbitali atomici rappresentano le regioni tridimensionali all’interno delle quali è probabile che si trova l’elettrone. Tutti gli orbitali insieme formano una forma approssimativamente sferica, motivo per cui gli atomi sono generalmente rappresentati come sfere.
Questo testo è adattato da Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
