8.5:
Affinità elettronica
8.5:
Affinità elettronica
L’affinità elettronica (EA) è il cambiamento di energia per l’aggiunta di un elettrone ad un atomo gassoso per formare un anione (ione negativo).
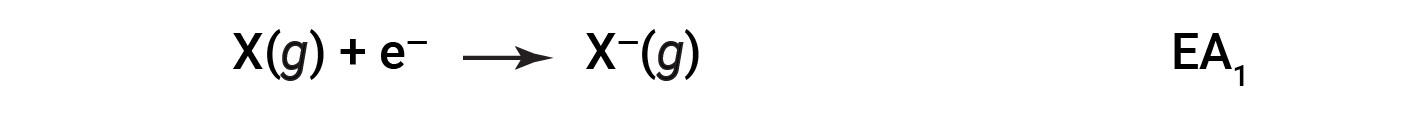
Questo processo può essere endotermico o esotermico, a seconda dell’elemento. Molti di questi elementi hanno valori negativi di EA, il che significa che l’energia viene rilasciata quando l’atomo gassoso accetta un elettrone. Tuttavia, per alcuni elementi, l’energia è necessaria affinché l’atomo diventi caricato negativamente, e il valore della loro EA è positivo. Proprio come con l’energia di ionizzazione, i successivi valori EA sono associati alla formazione di ioni con più carica. La seconda EA è l’energia associata all’aggiunta di un elettrone ad un anione per formare uno 2- ione, e così via.
Come si potrebbe prevedere, diventa più facile aggiungere un elettrone attraverso una serie di atomi all’aumentare della carica nucleare effettiva degli atomi. Man mano che andiamo da sinistra a destra attraverso un periodo, le EA tendono a diventare più negative. Le eccezioni riscontrate tra gli elementi del gruppo 2 (2A), del gruppo 15 (5A) e del gruppo 18 (8A) possono essere comprese in base alla struttura elettronica di questi gruppi. I gas nobili, gruppo 18 (8A), hanno un guscio completamente riempito, e l’elettrone in entrata deve essere aggiunto ad un livello n più alto, che è più difficile da fare. Il gruppo 2 (2A) ha una sottoshell ns riempita, e quindi il prossimo elettrone aggiunto va nell’energia più alta np, quindi, ancora una volta, il valore EA osservato non è come la tendenza prevederebbe. Infine, il gruppo 15 (5A) ha una sottoshell np semi-riempita, e l’elettrone successivo deve essere accoppiato con un elettrone np esistente. In tutti questi casi, la stabilità relativa iniziale della configurazione elettronica interrompe la tendenza in EA.
Ci si potrebbe aspettare che l’atomo nella parte superiore di ogni gruppo abbia l’EA più negativo; i loro primi potenziali di ionizzazione suggeriscono che questi atomi hanno le più grandi cariche nucleari effettive. Tuttavia, mentre ci spostiamo verso il basso di un gruppo, vediamo che il secondo elemento del gruppo ha più spesso l’EA più negativo. Questo può essere attribuito alle piccole dimensioni del guscio n = 2 e alle grandi repulsioni elettrone-elettrone risultanti. Ad esempio, il cloro, con un valore EA di –348 kJ/mol, ha il valore più alto di qualsiasi elemento nella tavola periodica. L’EA del fluoro è di -322 kJ/mol. Quando aggiungiamo un elettrone ad un atomo di fluoro per formare un anione fluoruro (F–), aggiungiamo un elettrone al guscio n = 2. L’elettrone è attratto dal nucleo, ma c’è anche una significativa repulsione dagli altri elettroni già presenti in questo piccolo guscio di valenza. L’atomo di cloro ha la stessa configurazione elettronica nel guscio di valenza, ma poiché l’elettrone che entra sta entrando nel guscio n = 3, occupa una regione dello spazio considerevolmente più grande e le repulsioni elettrone-elettrone sono ridotte. L’elettrone che entra non sperimenta tanta repulsione, e l’atomo di cloro accetta un elettrone aggiuntivo più facilmente, risultando in un EA più negativo.
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 6.5: Variazioni periodiche nelle proprietà degli elementi.
