10.9:
Teoria dell'orbitale molecolare II
10.9:
Teoria dell'orbitale molecolare II
Diagrammi di energia orbitale molecolare
I livelli di energia relativa degli orbitali atomici e molecolari sono tipicamente mostrati in un diagramma orbitale molecolare. Per una molecola biatomica, gli orbitali atomici di un atomo sono mostrati a sinistra, e quelli dell’altro atomo sono mostrati a destra. Ogni linea orizzontale rappresenta un orbitale in grado di contenere due elettroni. Gli orbitali molecolari formati dalla combinazione degli orbitali atomici sono mostrati al centro. Le linee tratteggiate mostrano quale degli orbitali atomici si combina per formare gli orbitali molecolari. Per ogni coppia di orbitali atomici che si combinano, un orbitale molecolare a bassa energia (legame) e un risultato orbitale ad alta energia (antibonding).
La distribuzione degli elettroni in questi orbitali molecolari è fatta secondo il principio di aufbau. Gli orbitali a bassa energia si riempiono per primi; gli elettroni si diffondono tra orbitali degenerati prima dell’accoppiamento, e ogni orbitale può contenere un massimo di due elettroni con spin opposti.
Ordine obbligazionario
Il diagramma orbitale molecolare riempito mostra il numero di elettroni sia negli orbitali molecolari di legame che in quello antiobbding. Il contributo netto degli elettroni alla forza di legame di una molecola è identificato determinando l’ordine di legame. Nel modello orbitale molecolare, un elettrone contribuisce ad un’interazione di legame se occupa un orbitale legante, e contribuisce ad un’interazione antibonding se occupa un orbitale antibonding. L’ordine di legame è calcolato sottraendo gli elettroni destabilizzanti (antibonding) dagli elettroni stabilizzanti (leganti). Poiché un legame è costituito da due elettroni, dividiamo per due per ottenere l’ordine di legame. L’equazione per determinare l’ordine di legame è la seguente:
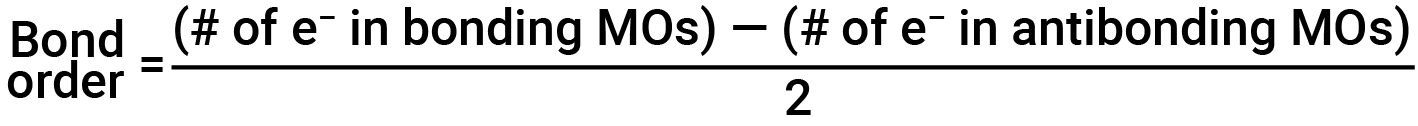
L’ordine di legame è una guida alla forza di un legame covalente; un legame tra due atomi dati diventa più forte all’aumentare dell’ordine di legame. Se la distribuzione degli elettroni negli orbitali molecolari tra due atomi è tale che il legame risultante avrebbe un ordine di legame pari a zero, un legame stabile non si forma.
Legame in molecole biatomiche omonucleari
Una molecola di idrogeno (H2)si forma da due atomi di idrogeno. Quando gli orbitali atomici dei due atomi si combinano, gli elettroni occupano l’orbitale molecolare dell’energia più bassa, σ orbitale di legame1s. Una molecola di diidrogeno, H2, si forma facilmente perché l’energia di una molecola H2 è inferiore a quella di due atomi H. Entrambi gli elettroni nella molecola H2 sono nel σ orbitale di legame1s; la configurazione elettronica è (σ1s)2. Questa configurazione è rappresentata da un diagramma di energia orbitale molecolare in cui una singola freccia verso l’alto indica un elettrone su un orbitale, e due frecce (verso l’alto e verso il basso) indicano due elettroni di spin opposto. Una molecola di diidrogeno contiene due elettroni leganti e nessun elettrone antibonding, quindi l’ordine di legame è uguale a 1. Quindi, il legame H-H è un singolo legame.
Un atomo di elio ha due elettroni, entrambi nel suo orbitale 1s. Due atomi di elio non si combinano per formare una molecola di dielio, He2, con quattro elettroni, perché l’effetto stabilizzante dei due elettroni nell’orbitale di legame a bassa energia sarebbe compensato dall’effetto destabilizzante dei due elettroni nell’orbitale molecolare antibonding ad alta energia. L’ipotetica configurazione elettronica di He2 è (σ1s)2(σ*1s)2. L’ordine di legame in un’ipotetica molecola di dielio sarebbe zero. Ciò indica che non si forma alcun legame tra i due atomi di elio.
Legame in molecole biatomiche omonucleari del secondo periodo
Otto possibili molecole biatomiche omonuclearipotrebberoessere formate dagli atomi del secondo periodo della tavola periodica: Li2, Be2, B2, C2, N 2 , O2, F2e Ne2. Lamolecola Be 2 e la molecola Ne2 non sarebbero stabili a causa dell’ordine di legame zero.
Per le configurazioni degli elettroni orbitali molecolari di valenza, gli elettroni di valenza sono assegnati agli orbitali molecolari di valenza con le energie più basse possibili. Coerentemente con la regola di Hund, ogni volta che ci sono due o più orbitali molecolari degenerati, gli elettroni riempiono ogni orbitale di quel tipo singolarmente prima che abbia luogo qualsiasi accoppiamento di elettroni.
σ orbitali sono solitamente più stabili degli π orbitali. Tuttavia, non è sempre così. Per gli atomi con tre o meno elettroni negli orbitali p (da Li a N), si osserva uno schema diverso, in cui l’orbitale σp è più alto in energia rispetto all’insieme πp.
Questo interruttore nell’ordinamento orbitale si verifica a causa di un fenomeno chiamato miscelazione s–p. lamiscelazione s – p non crea nuovi orbitali; influenza semplicemente le energie degli orbitali molecolari esistenti. La funzione d’onda σs si combina matematicamente con la funzione d’onda σp, con il risultato che l’orbitale σs diventa più stabile, e l’orbitale σp diventa meno stabile. Allo stesso modo, gli orbitali antibonding subiscono anche la miscelazione s–p, con i σs* che diventano più stabili e il σp* diventa meno stabile.
Lamiscelazione s – p si verifica quando gli orbitali s e p hanno energie simili. La differenza di energia traorbitali 2 s e 2p in O, F e Ne è maggiore di quella in Li, Be, B, C e N. Per questo motivo, O2, F2e Ne2 mostrano una miscelazione s–p trascurabile (non sufficiente a cambiare l’ordinamento energetico), e i loro diagrammi MO seguono il modello normale, come mostrato nella figura precedente. Tutte le altre molecole biatomiche dell’altro periodo 2 hanno la miscelazione s–p, che porta allo schema in cui l’orbitale σp è sollevato sopra l’insieme πp.
Questo testo è adattato da Openstax, Chemistry 2e, Section 8.4: Molecular Orbital Theory.
