12.13:
Colloidi
12.13:
Colloidi
I bambini in gioco spesso fanno sospensioni come miscele di fango e acqua, farina e acqua, o una sospensione di pigmenti solidi nell’acqua nota come vernice tempera. Queste sospensioni sono miscele eterogenee composte da particelle relativamente grandi che sono visibili ad occhio nudo o possono essere viste con una lente d’ingrandimento. Sono nuvolosi e le particelle sospese si depositano dopo la miscelazione. D’altra parte, una soluzione è una miscela omogenea in cui non si verifica alcun sedimentazione e in cui le specie disciolte sono molecole o ioni. Le soluzioni mostrano un comportamento completamente diverso dalle sospensioni. Una soluzione può essere colorata, ma è trasparente, le molecole o gli ioni sono invisibili e non si depositano in piedi. Un’altra classe di miscele chiamate colloidi (o dispersioni colloidali) mostra proprietà intermedie tra quelle delle sospensioni e delle soluzioni. Le particelle in un colloide sono più grandi della maggior parte delle molecole semplici; tuttavia, le particelle colloidali sono abbastanza piccole da non stabilirsi in piedi.
Preparazione dei sistemi colloidali
I colloidi vengono preparati producendo particelle di dimensioni colloidali e distribuendo queste particelle attraverso un mezzo di dispersione. Le particelle di dimensione colloidale sono formate da due metodi:
• Metodi di dispersione: scomporsi particelle più grandi. Ad esempio, i pigmenti di vernice sono prodotti disperdendo particelle di grandi dimensioni macinando in mulini speciali.
• Metodi di condensazione: crescita da unità più piccole, come molecole o ioni. Ad esempio, le nuvole si formano quando le molecole d’acqua si condensano e formano goccioline molto piccole.
Alcune sostanze solide, se portate a contatto con l’acqua, si disperdono spontaneamente e formano sistemi colloidali. Gelatina, colla, amido e latte in polvere disidratato si comportano in questo modo. Le particelle sono già di dimensioni colloidali; l’acqua li disperde semplicemente. Le particelle di latte in polvere di dimensioni colloidali sono prodotte dalla disidratazione dello spray al latte. Alcuni atomizzatori producono dispersioni colloidali di un liquido nell’aria.
Un’emulsione può essere preparata scuotendo insieme o mescolando due liquidi immiscibili. Questo rompe un liquido in goccioline di dimensioni colloidali, che poi si disperdono in tutto l’altro liquido. Le fuoriuscite di petrolio nell’oceano possono essere difficili da ripulire, in parte perché l’azione delle onde può causare la formare un’emulsione di petrolio e acqua. In molte emulsioni, tuttavia, la fase dispersa tende a coalizzarsi, formare grandi gocce e separarsi. Pertanto, le emulsioni sono solitamente stabilizzate da un agente emulsionante, una sostanza che inibisce la coalescenza del liquido disperso. Ad esempio, un po ‘di sapone stabilizzerà un’emulsione di cherosene in acqua. Il latte è un’emulsione di grasso di burro in acqua, con la caseina proteica che funge da agente emulsionante. La maionese è un’emulsione di olio nell’aceto, con componenti di tuorlo d’uovo come agenti emulsionanti.
I metodi di condensazione formano particelle colloidali per aggregazione di molecole o ioni. Se le particelle crescono oltre l’intervallo di dimensioni colloidali, si formano gocce o precipitati e non si verifica alcun sistema colloidale. Le nubi si formano quando le molecole d’acqua si aggregano e formano particelle di dimensioni colloidi. Se queste particelle d’acqua si uniranno per formare gocce d’acqua adeguatamente grandi di acqua liquida o cristalli di acqua solida, si depositano dal cielo come pioggia, nevischio o neve. Molti metodi di condensazione comportano reazioni chimiche. Una sospensione colloidale rossa dell’idrossido di ferro(III) può essere preparata mescolando una soluzione concentrata di cloruro di ferro(III) con acqua calda:

Un sol d’oro colloidale risulta dalla riduzione di una soluzione molto diluita di cloruro d’oro(III) da parte di un agente riducente come formaldeide, cloruro di stagno(II) o solfato di ferro(II):
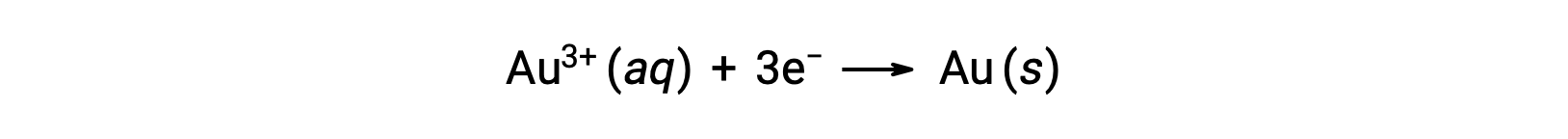
Alcuni sol d’oro preparati nel 1857 sono ancora intatti (le particelle non si sono coalizzate e sistemate), illustrando la stabilità a lungo termine di molti colloidi.
Saponi e detergenti
I pionieri hanno fatto il sapone facendo bollire i grassi con una soluzione fortemente basilare realizzata con carbonato di potassio lisciviazione, K2CO3,da ceneri di legno con acqua calda. I grassi animali contengono poliesteri di acidi grassi (acidi carbossilici a catena lunga). Quando i grassi animali vengono trattati con una base come carbonato di potassio o idrossido di sodio, si formano glicerolo e sali di acidi grassi come acido palmitico, oleico e stearico. I sali degli acidi grassi sono chiamati saponi. Il sale di sodio dell’acido stearico, lo stearato di sodio, contiene una catena di idrocarburi non polari non carica, l’unità C17H35 e un gruppo carbossilato ionico, l’unità COO−.
L’azione detergente di saponi e detergenti può essere spiegata in termini di strutture delle molecole coinvolte. L’estremità idrocarburica (non polare) di una molecola di sapone o detergente si dissolve o è attratta da sostanze non polari, come olio, grasso o particelle di sporco. L’estremità ionica è attratta dall’acqua (polare). Di conseguenza, le molecole di sapone o detergente diventano orientate all’interfaccia tra le particelle di sporco e l’acqua, quindi agiscono come una sorta di ponte tra due diversi tipi di materia, non polare e polare. Molecole come questa sono detfile poiché hanno sia una parte idrofobica (“che teme l’acqua”) che una parte idrofila (“amante dell’acqua”). Di conseguenza, le particelle di sporco vengono sospese come particelle colloidali e vengono prontamente lavate via.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.5: Colloidi.
Suggested Reading
- Riley, John T. "Appetizing colloids." Journal of Chemical Education 57, no. 2 (1980): 153.
- Friberg, Stig E., and Beverly Bendiksen. "A simple experiment illustrating the structure of association colloids." Journal of Chemical Education 56, no. 8 (1979): 553.
- Liang, Fuxin, Bing Liu, Zheng Cao, and Zhenzhong Yang. "Janus colloids toward interfacial engineering." Langmuir 34, no. 14 (2017): 4123-4131.
- Hansen, Robert S., and C. A. Smolders. "Colloid and surface chemistry in the mainstream of modern chemistry." (1962): 167.
