15.8:
Soluzioni di basi deboli
15.8:
Soluzioni di basi deboli
Alcuni composti producono ioni idrossido quando vengono sciolti reagendo chimicamente con molecole d’acqua. In tutti i casi, questi composti reagiscono solo parzialmente e quindi sono classificati come basi deboli. Questi tipi di composti sono anche abbondanti in natura e materie prime importanti in varie tecnologie. Ad esempio, la produzione globale dell’ammoniaca di base debole è in genere ben oltre le 100 tonnellate metriche all’anno, essendo ampiamente utilizzata come fertilizzante agricolo, una materia prima per la sintesi chimica di altri composti e un principio attivo nei detergenti domestici. Quando viene sciolta in acqua, l’ammoniaca reagisce parzialmente alla produzione di ioni idrossido, come mostrato qui:
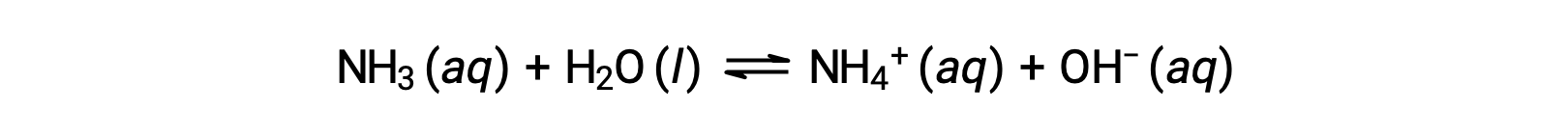
Questa è, per definizione, una reazione acido-base, in questo caso che comporta il trasferimento di ioni H+ da molecole d’acqua a molecole di ammoniaca. In condizioni tipiche, solo circa l’1% dell’ammoniaca disciolta è presente comeNH 4+ ioni.
Calcolo delle concentrazioni di ioni idrossido e del pOH in una soluzione di base debole
Trova la concentrazione di ione idrossido, il pOH e il pH di una soluzione di 0,25 M di trimetilammina, una base debole:
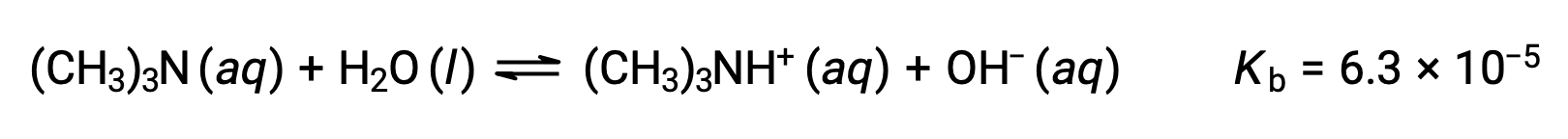
La tabella ICE per questo sistema è
| (CH3) 3 la commissione per l’ N (aq) | (CH3) 3 la commissione per l’ NH+ (aq) | OH− (aq) | |
| Concentrazione iniziale (M) | 0.25 | 0 | ~0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 0,25 − x | 0 + x | ~0 + x |
Sostituendo i termini di concentrazione di equilibrio nell’espressione Kb si ottiene
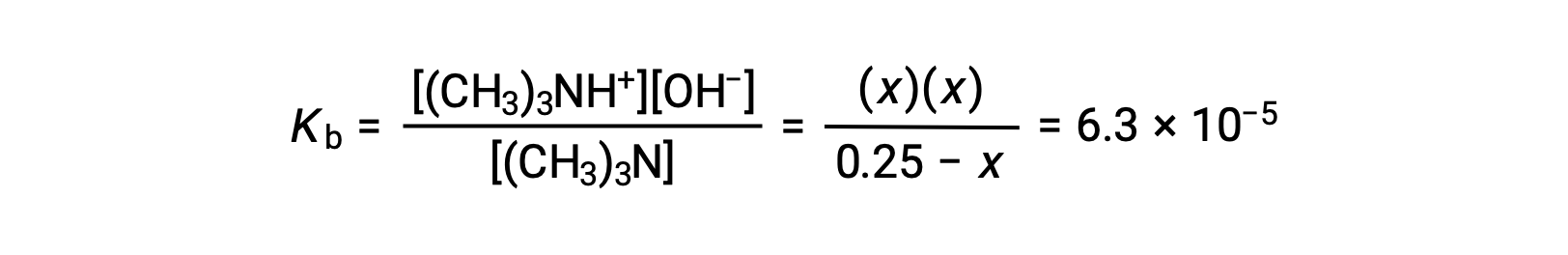
Assunzione di x << 0,25 e risoluzione dei rendimenti x
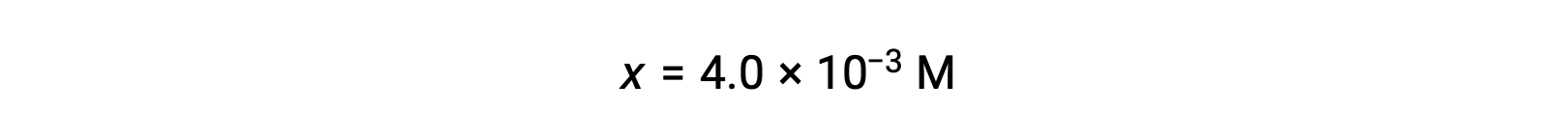
Questo valore è inferiore al 5% della concentrazione iniziale (0,25), quindi l’ipotesi è giustificata.
Come definito nella tabella ICE, x è uguale alla concentrazione di equilibrio dello ione idrossido:
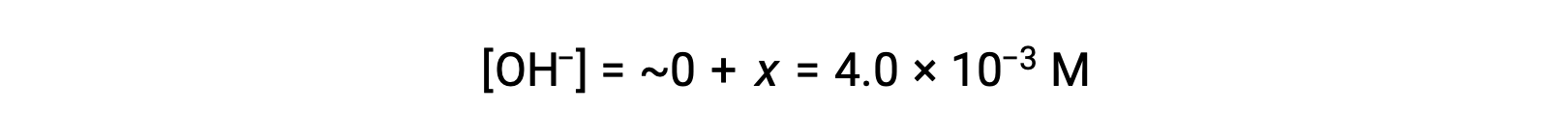
Il pOH è calcolato per essere
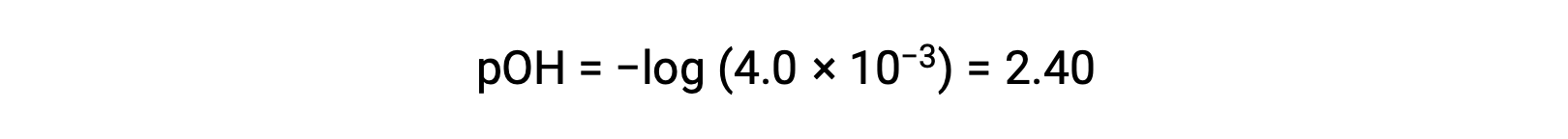
Utilizzando la relazione;
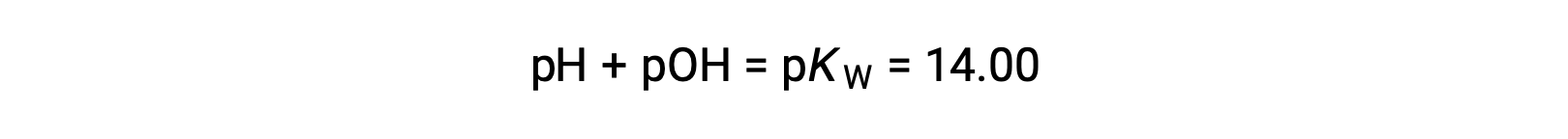
permette il calcolo del pH:
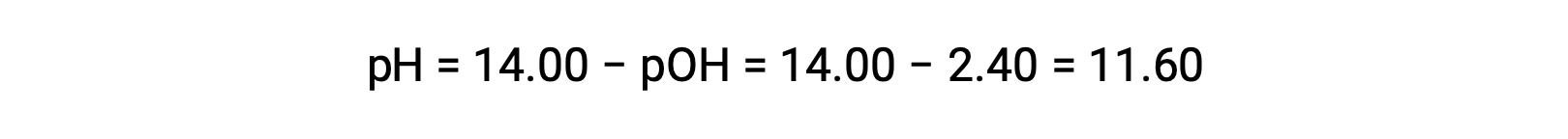
Determinazione di Kb dal pH
Se il pH della soluzione di 0,28 M di etilammina (C2H5NH2) è 12,10, qual è il suo Kb?
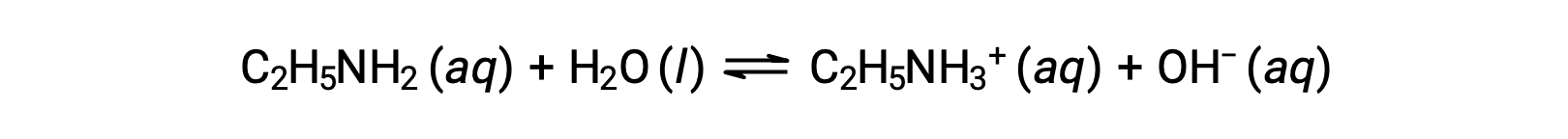
Per calcolare il Kb dell’etilammina, è necessario prima determinare il pOH e la concentrazione di ioni idrossido. Poiché il pH è 12,10, il pOH può essere calcolato come segue:
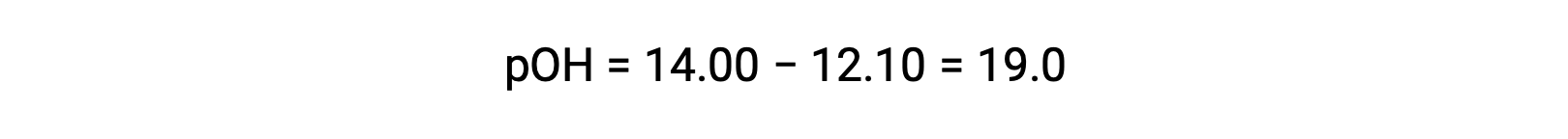
Poiché il pOH è 1,90, la concentrazione di ioni idrossido della soluzione può essere calcolata utilizzando la formula
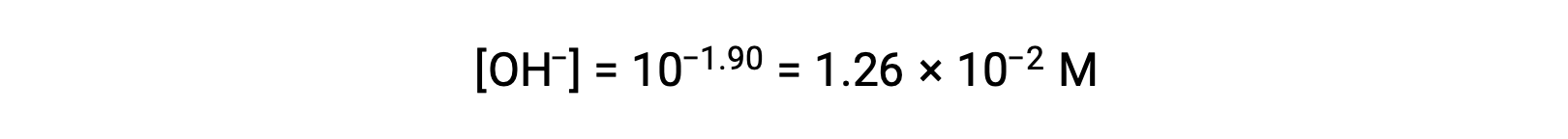
La tabella ICE può essere costruita per questo sistema come segue
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH− (aq) | |
| Concentrazione iniziale (M) | 0.28 | 0 | ~0 |
| Variazione (M) | -0,0126 | +0.0126 | +0.0126 |
| Concentrazione di equilibrio (M) | 0,28 − 0,0126 | 0.0126 | 0.0126 |
Poiché lo 0,0126 M è pari al 4,5% di 0,28 M, 0,28 − 0,0126 può essere considerato quasi uguale a 0,28 M dalla regola del 5%.
Dopo aver sostituendo i valori di cui sopra nell’espressione con il Kb dell’etilammina,
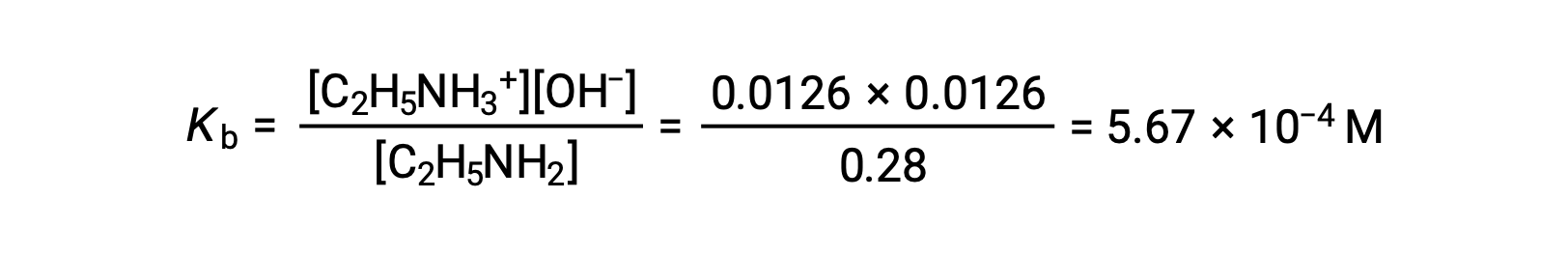
Questo testo è adattato da Openstax, Chimica 2e Sezione 4.2: Classificazione delle reazioni chimiche e 14.3 Punti di forza relativi di acidi e basi.
